Содержание
- 1 История
- 2 Физические свойства, способы получения и нахождение в природе кремния
- 3 Химические свойства
- 4 Распространение Кремния в природе
- 5 Где добывают
- 6 Запасы, руды, минералы
- 7 Свойства и характеристики
- 8 Способы получения кремния
- 9 Сплавы, получение кремния
- 10 Производство неметалла
- 11 Применение Кремния
- 12 Применение кремния в медицине
- 13 Биологическая роль и функции кремния в организме
- 14 Взаимодействие кремния с другими веществами
- 15 Кремниевые формы жизни
- 16 Интересные факты о кремнии
- 17 Современные исследования
История
О химическом элементе впервые заговорили в 1811 году французские химики Жозеф Луи Гей-Люссак и Луи Жак Тенар.
В 1823 году ученый Йенс Якобс Берцелиус в результате опытов восстановил тетрафторид кремния калием и получил аморфную модификацию. Именно Берцелиус предложил латинское название – «silicis».
В 1834 году российский ученый Герман Гесс дал кремнию имя. В переводе с древнегреческого языка оно значит «утес».
Опыты по изучению физических свойств элемента продолжились. И через 20 лет французский ученый Сент Клер-Девилль вывел еще один вид – кристаллический.
![]()
Физические свойства, способы получения и нахождение в природе кремния
Кремний — второй по распространенности элемент на Земле после кислорода. Встречается только в виде соединений. Оксид кремния SiO2 образует большое количество природных веществ – горный хрусталь, кварц, кремнезем.

Простое вещество кремний – атомный кристалл темно-серого цвета с металлическим блеском, довольно хрупок. Температура плавления 1415 °C, плотность 2,33 г/см3. Полупроводник.
Электронное строение кремния
Электронная конфигурация кремния восновном состоянии:
+14Si 1s22s22p63s23p2 
Электронная конфигурация кремния ввозбужденном состоянии:
+14Si* 1s22s22p63s13p3 
Атом кремния содержит на внешнем энергетическом уровне 2 неспаренных электрона и 1 неподеленную электронную пару в основном энергетическом состоянии и 4 неспаренных электрона в возбужденном энергетическом состоянии.
Степени окисления атома кремния — от -4 до +4. Характерные степени окисления -4, 0, +2, +4.
Качественные реакции
Качественная реакция насиликат-ионы SiO32- — взаимодействие солей-силикатов с сильными кислотами. Кремниевая кислота – слабая. Она легко выделяется из растворов солей кремниевой кислоты при действии на них более сильными кислотами.
Например, если к раствору силиката натрия прилить сильно разбавленный раствор соляной кислоты, то кремниевая кислота выделится не в виде осадка, а в виде геля. Раствор помутнеет и «застынет».
Na2SiO3 + 2HCl = H2SiO3 + 2 NaCl

Видеоопытвзаимодействия силиката натрия с соляной кислоты (получение кремниевой кислоты) можно посмотреть здесь.
Соединения кремния
Основные степени окисления кремния +4, 0 и -4.
Наиболее типичные соединения кремния:
| Степень окисления | Типичные соединения |
| +4 | оксид кремния (IV) SiO2 кремниевая кислота H2SiO3 силикаты MeSiO3 бинарные соединения с неметаллами (карбид кремния SiC) |
| -4 | силан SiH4 силициды металлов (силицид натрия Na4Si) |
Морфология
![]()
Чаще всего в природе кремний встречается в виде кремнезёма — соединений на основе диоксида кремния (IV) SiO2 (около 12 % массы земной коры). Основные минералы и горные породы, образуемые диоксидом кремния, — это песок (речной и кварцевый), кварц и кварциты, кремень, полевые шпаты. Вторую по распространённости в природе группу соединений кремния составляют силикаты и алюмосиликаты.
Отмечены единичные факты нахождения чистого кремния в самородном виде.
Классификация
| Strunz (8-ое издание) | 1/B.05-10 |
| Nickel-Strunz (10-ое издание) | 1.CB.15 |
| Dana (7-ое издание) | 1.3.6.1 |
| Dana (8-ое издание) | 1.3.7.1 |
| Hey’s CIM Ref. | 1.28 |
Оптические свойства
| Тип | изотропный |
| Показатели преломления | nω = 3.4223 |
| Анизотропия | нет |
| Плеохроизм | нет |
| Люминесценция в ультрафиолетовом излучении | не флюоресцентный |
Кристаллография
| Точечная группа | (4/m 3 2/m) — изометрическая-гексаоктаэдральная |
| Пространственная группа | F d3m |
| Сингония | кубическая |
| Параметры ячейки | a = 5.431 |
| Двойникование | нет |
Оксид кремния (IV)
Физические свойства и нахождение в природе
Оксид кремния (IV) – это твердое вещество с атомной кристаллической решеткой. В природе встречается в виде кварца, речного песка, кремнезема и прочих модификаций:

Химические свойства
Оксид кремния (IV) – типичный кислотный оксид. За счет кремния со степенью окисления +4 проявляет слабые окислительные свойства.
1. Как кислотный оксид, диоксид кремния (IV) взаимодействует с растворами и расплавами щелочейи в расплаве с основными оксидами. При этом образуются силикаты.
Например, диоксид кремния взаимодействует с гидроксидом калия:
SiO2 + 2KOH → K2SiO3 + H2O
Еще пример: диоксид кремния взаимодействует с оксидом кальция.
SiO2 + CaO → CaSiO3
2. Оксид кремния (IV) не взаимодействуетс водой, т.к. кремниевая кислота нерастворима.
3.Оксид кремния (IV) реагирует при сплавлении скарбонатами щелочных металлов. При этом работает правило: менее летучий оксид вытесняет более летучий оксид из солей при сплавлении.
Например, оксид кремния (IV) взаимодействует с карбонатом калия. При этом образуется силикат калия и углекислый газ:
SiO2 + K2CO3 → K2SiO3 + CO2
4.Из кислот диоксид кремния реагирует только с плавиковойили с газообразным фтороводородом:
SiO2 + 4HF(г) = SiF4 + 2H2O
SiO2 + 6HF(р-р) → H2[SiF6] + 2H2O
5.При температуре выше 1000 °С оксид кремния реагирует с активными металлами, при этом образуется кремний.
Например, оксид кремния взаимодействует с магнием с образованием кремния и оксида магния:
SiO2 + 2Mg → Si + 2MgO
Видеоопытвзаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
При избытке восстановителя образуются силициды:
SiO2 + 4Mg → Mg2Si + 2MgO
6. Оксид кремния (IV) взаимодействует с неметаллами.
Например, оксид кремния (IV) реагирует с водородом в жестких условиях. При этом оксид кремния проявляет окислительные свойства:
SiO2 + 2Н2 → Si + 2Н2O
Ещепример: оксид кремния взаимодействует с углеродом. При этом образуется карборунд и угарный газ:
SiO2 + 3С → SiС + 2СО
При сплавлении оксид кремния взаимодействует с фосфатом кальция и углем:
3SiO2 + Ca3(PO4)2 + 5C → 3CaSiO3 + 5CO + 2P
Химические свойства
При нормальных условиях кремний существует в виде атомного кристалла, поэтому химическая активность кремния крайне невысокая.
1. Кремний проявляет свойстваокислителя(при взаимодействии с элементами, которые расположены ниже и левее в Периодической системе) и свойствавосстановителя(при взаимодействии с элементами, расположенными выше и правее). Поэтому кремний реагирует и сметаллами, и снеметаллами.
1.1. При обычных условиях кремний реагирует с фтором с образованием фторида кремния (IV):
Si + 2F2 → SiF4
При нагревании кремний реагируетсхлором, бромом, йодом:
Si + 2Cl2 → SiCl4
Si + 2Br2 → SiBr4
1.2. При сильном нагревании (около 2000оС) кремний реагируетс углеродом с образованием бинарного соединения карбида кремния (карборунда):
C + Si → SiC
При температуре выше 600°С взаимодействует с серой:
Si + 2S → SiS2
1.3.Кремний не взаимодействует с водородом.
1.4.С азотом кремний реагирует в очень жестких условиях:
3Si + 2N2 → Si3N4
1.5.В реакциях сактивными металлами кремний проявляет свойства окислителя. При этом образуются силициды:
2Ca + Si → Ca2Si
Si + 2Mg → Mg2Si
1.6. При нагревании выше 400°С кремний взаимодействуетс кислородом:
Si + O2 → SiO2
2.Кремний взаимодействует сосложными веществами:
2.1. В водных растворахщелочейкремний растворяется с образованием солей кремниевой кислоты. При этом щелочь окисляет кремний.
Si + 2NaOH + H2O → Na2SiO3 + 2H2
Видеоопыт взаимодействия кремния с раствором щелочи можно посмотреть здесь.
2.2.Кремний не взаимодействует с водными растворами кислот, но аморфный кремний растворяется в плавиковой кислоте с образованием гексафторкремниевой кислоты:
Si + 6HF → H2[SiF6] + 2H2
При обработке кремния безводным фтороводородом комплекс не образуется:
Si(тв.) + 4HF(г.) = SiF4 + 2H2
С хлороводородом кремний реагирует при 300 °С, с бромоводородом – при 500 °С.
2.3. Кремний растворяется всмеси концентрированных азотной и плавиковой кислот:
3Si + 4HNO3 + 12HF → 3SiF4 + 4NO + 8H2O
Бинарные соединения кремния
Реакции с неметаллами
При взаимодействии с неметаллами кремний проявляет восстановительные свойства – отдаёт электроны. Реакции возможны только при сильном нагревании. При нормальных условиях кремний реагирует только с фтором. Реакции с основными неметаллами приведены в таблице.
| Элемент | Описание | Реакция |
| Фтор | При обычных условиях | Si + 2F2 → SiF4 |
| Кислород | Взаимодействует при 600°C с образованием диоксида (песка) | Si + O2 → SiO2 |
| Хлор | Реагирует при 400°C | Si + 2Cl2 → SiCl4 |
| Углерод | Реагирует при 2000°C с образованием карборунда | Si + C → SiC |
| Азот | Протекает при 1000°C | 3Si + 2N2 → Si3N4 |
| Сера | Реагирует при 1000°C | Si + 2S → SiS2 |
| Бор | Взаимодействует при 2000°C | Si + 3B → B3Si |
Гидрид кремния – силан (SiH4) – можно получить путём разложения силицидов кислотой. Например, Mg2Si + 2H2SO4 → SiH4 + 2MgSO4.
Взаимодействие с металлами
Окислительные свойства кремний проявляет только в реакциях с металлами. При сплавлении образуются соли – силициды:
- Si + 2Mg → Mg2Si;
- Si + 2Ca → Ca2Si;
- Si + Na → NaSi;
- 2Si + Fe → FeSi2.
Силициды используются в промышленности для производства сплавов и материалов. В качестве сверхпроводника используется силицид ванадия (V3Si), полупроводника – силицид рения (ReSi).
Реакции со сложными веществами
Помимо простых веществ кремний реагирует со сложными соединениями – кислотами и щелочами. Основные реакции описаны в таблице.
| Реакция | Описание | Уравнение |
| С галогеноводородами | Реагирует с плавиковой кислотой при обычных условиях, с соляной кислотой – при 300°С, с бромоводородом – при 500°С | – Si + 4HF → SiF4 + 2H2; – Si + 4HCl → SiCl4 + 2H2; – Si + 4HBr → SiBr4 + 2H2 |
| С кислотами | Является устойчивым по отношению к кислотам, покрываясь оксидной плёнкой. Реакция идёт только со смесью азотной и плавиковой кислот | 3Si + 4HNO3 + 18HF → 3H2[SiF6] + 4NO + 8H2O |
| Со щелочами | В водных растворах растворяется, образуя силикаты и водород | Si + 2KOH + H2O → K2SiO3 + H2 |
При 1200°C кремний реагирует с диоксидом, образуя монооксид: Si + SiO2 → SiO.
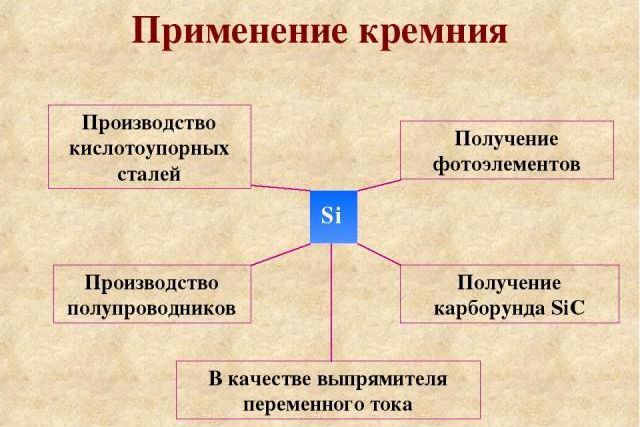
Рис. 3. Применение кремния.
Распространение Кремния в природе
По распространенности в земной коре Кремний — второй (после кислорода) элемент, его среднее содержание в литосфере 29,5% (по массе). В земной коре Кремний играет такую же первостепенную роль, как углерод в животном и растительном мире. Для геохимии Кремния важна исключительно прочная связь его с кислородом. Около 12% литосферы составляет кремнезем SiO2 в форме минерала кварца и его разновидностей. 75% литосферы слагают различные силикаты и алюмосиликаты (полевые шпаты, слюды, амфиболы и т. д.). Общее число минералов, содержащих кремнезем, превышает 400.
Где добывают
В чистом виде кремний практически не встречается. Геологи нашли частицы чистого вещества в трещинах вулканов на Камчатке, Кольском полуострове, в Карелии.
Также микроскопическое содержание элемента замечено в Красноярском крае, в природном заповеднике Кузнецкий Алатау в районе Западной Сибири.
В природе распространен кремнезем – диоксид кремния. Его содержание в земной коре – примерно 11,9%.
Элемент присутствует в горных породах:
- слюда;
- полевой шпат;
- слюда;
- опал;
- силикат;
- глина.
Содержание кремния — до 74-76%. Количество вещества зависит от вида породы.
Химический элемент залегает глубоко в почве, на дне океанов и морей. Он скапливается в скелетах и панцирях морских животных. Поэтому на морском дне образуются крупные залежи диоксида.

Запасы, руды, минералы
Основной минерал кремния — песок. Кроме него, существуют:
- кварц;
- кварциты;
- полевые шпаты;
- силикаты;
- алюмосиликаты.
Нашего героя в земной коре очень много (до 30% по массе). После углерода это второй элемент (по распространенности на планете).

Многие кремниевые соединения являются драгоценными и полудрагоценными камнями. Это аквамарин, изумруд, топаз, аметист, яшмы и топазы.
Свойства и характеристики

Поскольку в промышленности чаще всего эксплуатируется кристаллический кремний, то именно его свойства и являются более важными, и именно они и приводятся в технических характеристиках. Физические свойства вещества таковы:
- температура плавления – 1417 С;
- температура кипения – 2600 С;
- плотность составляет 2,33 г/куб. см, что свидетельствует о хрупкости;
- теплоемкость, как и теплопроводность не постоянны даже на самых чистых пробах: 800 Дж/(кг·К), или 0,191 кал/(г·град) и 84-126 вт/(м·К), или 0,20-0,30 кал/(см·сек·град) соответственно;
- прозрачен для длинноволнового ИК-излучения, что используется в инфракрасной оптике;
- диэлектрическая проницаемость – 1,17;
- твердость по шкале Мооса – 7.
Электрические свойства неметалла сильно зависят от примесей. В промышленности эту особенность используют, модулируя нужный тип полупроводника. При нормальной температуре кремний хрупок, но при нагревании выше 800 С возможна пластическая деформация.
Свойства аморфного кремния разительно отличаются: он сильно гигроскопичен, намного активнее вступает в реакцию даже при нормальной температуре.
Структура и химический состав, а также свойства кремния рассмотрены в видеоролике ниже:
Способы получения кремния
В свободном состоянии кремний был получен Берцелиусом в 1822 г. Его латинское название «силиций» произошло от латинского слова «sileх», что означает «кремень». Аморфный кремний в лаборатории можно получить при прокаливании смеси металлического магния с диоксидом кремния. Для опыта диоксид кремния следует тщательно измельчить. При нагревании смеси начинается бурная реакция. Одним из продуктов этой реакции является аморфный кремний.
SiO2 + 2Mg → Si + 2MgO
Видеоопытвзаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
Еще один способ получения кремнияв лаборатории— восстановление из оксида алюминием:
3SiO2 + 4Al → 3Si + 2Al2O3
В промышленностииспользовать дорогие алюминий и магний неэффективно, поэтому используют другие, более дешевые способы:
1.Восстановление из оксидакоксомв электрических печах:
SiO2 + 2C → Si + 2CO
Однако в таком процессе процессе образующийся кремний загрязнен примесями карбидов кремния, и для производства, например, микросхем уже не подходит.
2. Наиболее чистый кремний получают восстановлением тетрахлорида кремнияводородомпри 1200 °С:
SiCl4 +2H2 → Si + 4HCl
илицинком:
SiCl4 + 2Zn → Si + 2ZnCl2
3.Также чистый кремний получается при разложениисилана:
SiH4 → Si + 2H2
Сплавы, получение кремния
Silicium не может образовывать сплавы, это привилегия металлов. Зато он способен растворять многие металлы. Такие соединения, силициды, используют в промышленности.
К ним относят:
- силумин;
- ферросилиций;
- сплав РС-1004;
- сплав РС 1714;
- сплав РС 4800;
- сплав РС 5406.
Способы получения кремния:
- В печах шахтного типа восстановлением SiO2 коксом (технически чистый Silicium).
- Дальнейшую очистку продукта проводят по реакции SiCl4+2H2 = Si+4HCl (восстановление тетрахлорида водородом при высокой температуре).
Сверхчистый продукт (поликремний) для производства полупроводников и солнечных элементов очищают дополнительно.
Производство неметалла
Получить чистый кремний не так уж и просто, учитывая инертность его соединений и высокую температуру плавления большинства из них. В промышленности чаще всего прибегают к восстановлению углеродом из диоксида. Проводят реакцию в дуговых печах при температуре 1800 С. Таким образом получают неметалл чистотой в 99,9%, что для его применения недостаточно.
Полученный материал хлорируют с тем, чтобы получить хлориды и гидрохлориды. Затем соединения очищают всеми возможными методами от примесей и восстанавливают водородом.
Очистить вещество можно и за счет получения силицида магния. Силицид подвергают действию соляной или уксусной кислоты. Получают силан, а последний очищают различными способами – сорбционным, ректификацией и так далее. Затем силан разлагают на водород и кремний при температуре в 1000 С. В этом случае получают вещество с долей примеси 10-8–10-6%.
Применение Кремния
Специально легированный кремний широко применяется как материал для изготовления полупроводниковых приборов (транзисторы, термисторы, силовые выпрямители тока, тиристоры; солнечные фотоэлементы, используемые в космических кораблях, а так же много всякой всячины).
Поскольку кремний прозрачен для лучей с длиной волны от 1 до 9 мкм, его применяют в инфракрасной оптике.
Кремний имеет разнообразные и все расширяющиеся области применения. В металлургии Si
используется для удаления растворенного в расплавленных металлах кислорода (раскисления).
Кремний является составной частью большого числа сплавов железа и цветных металлов.
Обычно Кремний придает сплавам повышенную устойчивость к коррозии, улучшает их литейные свойства и повышает механическую прочность; однако при большем его содержании Кремний может вызвать хрупкость.
Наибольшее значение имеют железные, медные и алюминиевые сплавы, содержащие кремний.
Кремнезем перерабатываются стекольной, цементной, керамической, электротехнической и другими отраслями промышленности.
Сверхчистый кремний преимущественно используется для производства одиночных электронных приборов (например процессор твоего компьютера) и однокристальных микросхем.
Чистый кремний, отходы сверхчистого кремния, очищенный металлургический кремний в виде кристаллического кремния являются основным сырьевым материалом для солнечной энергетики.
Монокристаллический кремний — помимо электроники и солнечной энергетики используется для изготовления зеркал газовых лазеров.
Плюсы и минусы
Достоинств у кремния предостаточно. Это:
- Доступность в добыче минералов, легкость получения продукта.
- Наш герой нетоксичен, это дает возможность использовать его в любой отрасли промышленности.
- Электро-и радиотехника не может обойтись без полупроводниковых свойств неметалла.
- Кремний способен образовывать множество полезных и разнообразных соединений.
К недостаткам отнесем хрупкость неметалла при хорошей твердости.
Применение кремния в медицине
Применение Silicium целесообразно в следующих случаях:
- Восстановление организма после оперативного лечения хирургическим путем;
- Профилактика остеопороза;
- Восстановление здоровья волос, ногтей, кожи.
Биологическая роль и функции кремния в организме

Для чего нужен кремний организму? Как мы уже и говорили в начале статьи, Si играет важную роль в формировании и поддержании здоровья костной ткани, кожного покрова, волос, ногтей, а также кровеносных сосудов.
Количество кремния в костных тканях взрослого среднестатистического человека 17⋅10−4 %, в мышечных тканях — (1-2) ⋅10−2 %, в крови — 3,9 мг/л, а также гипофизе, щитовидной железе, надпочечниках, ногтях и волосах.
В нашем организме кремний больше всего содержится в щитовидной железе, надпочечниках, гипофизе. Самая высокая концентрация его обнаружена в волосах и ногтях.
Применение кремния в других сферах человеческой жизни
- Прежде всего, Si используют в качестве полупроводников для изготовления электроники, особенно микрочипов, транзисторов, диодов, солнечных панелей и прочих.
- В металлургии он пользуется успехом в качестве дополнительного материала в сплавах меди, алюминия, магния и прочих металлов, предавая сплавам более высокую прочность.
- Его добавляют в производстве кремнийорганических соединений – для изготовления пластика, искусственного каучука, технических силикатных смазок и масел.
- Используется и для производства неорганических материалов – керамики, стекла, изоляции, пьезокристаллов.
- В медицинской практике – для лечения остеопороза.
Кремний — суточная потребность
Суточная потребность в кремнии среднестатистического взрослого человека составляет 5 мг2. Максимальная суточная доза в Si – 10 мг. Хотя, некоторые источники утверждают, что суточная доза Silicium должна составлять от 20 до 50 мг.
Суточная доза кремния повышается при беременности, пременопаузе, после хирургического лечения, при переломах, высоких физических нагрузках на организм.
Терапевтической дозой кремния является до 12 мг в сутки3.
Нехватка кремния — симптомы
Дефицит Si может вызывать следующие нарушения в работе организма:
- Дряблость и сухость кожи, а также склонность к рецидивирующим кожным болезням – экземе, дерматиту, дерматозу, рожистым воспалениям и прочим. Раны заживают медленнее;
- Волосы становятся тусклыми, секутся и выпадают в повышенном количестве;
- Ногти также становятся более ломкими, периодически слоятся;
- Со временем развивается остеомаляция костей (размягчение костной ткани), остеопороз, артриты, склонность к переломам;
- Появляется ряд зубных болезней – кариес, пародонтоз;
- Развивается ряд заболеваний сердца и сосудов – артериальная гипертензия (гипертония), атеросклероз, ишемическая болезнь сердца, тромбофлебит, варикозное расширение вен, склонность к инфаркту и инсульту;
- Снижение аппетита;
- Повышенное утомление, периодическая слабость и апатия;
- Склонность к инфекционным болезням;
- Замедление роста ребенка;
- Бесплодие;
- Сосуды теряют свою эластичность, из-за чего при небольшом ушибе на коже появляются синяки, а также периодическое формирование сосудистых «звездочек».
- Кроме того, замечена связь между недостаточным количеством кремния в организме и наличием в это время следующих болезней – катаракта, сахарный диабет, дисбактериоз, гепатит, наличие камней в желчном пузыре (ЖКБ) и почках (ПКБ), злокачественные опухоли (рак).
Взаимодействие кремния с другими веществами
- Усиливает антиоксидантную активность витаминов А, Е и С;
- Улучшает усвоение следующих макро- и микроэлементов – кальция, калия, магния, натрия, фосфора, фтора и серы;
- Является антагонистом молибдена, из-за чего при их одновременном применении, активность обоих снижается. Кроме того, прием повышенных дох молибдена снижает усвояемость кремния;
- При взаимодействии с алюминием и марганцем образовывает нерастворимые силикаты, которые могут оседать в организме;
- Нейтрализует вредное действие на организм нитратов, солей свинца, хлор, ртути и прочих тяжелых металлов.
Кремниевые формы жизни
Группа IV Периодической таблицы элементов содержит углерод C, силициум (кремний) Si и несколько тяжелых металлов. Это значит, что степень окисления кремния равна +4. Углерод, конечно, является строительным материалом жизни, какой мы ее знаем. Но теоретики альтернативной биохимии предполагают, что населенная живыми существами планета может существовать в какой-то другой солнечной системе. У такой формы жизни кремний якобы может заменять углерод.
Многие научно-фантастические произведения рассказывают о кремниевых формах жизни — чувствительные кристаллы, живые золотые песчинки и даже существа, чьими следами являются кирпичи из кремнезема. Это интересно, но неправильно. Кремний может превратиться во множество реалистичных структур, но его химические свойства делают маловероятной возможность стать основой для инопланетных форм жизни.

Действительно, углерод и силиций имеют много общих характеристик. Валентность кремния равна четырем, это означает, что отдельные атомы образуют четыре связи с другими элементами при образовании химических соединений. И силиций, и углерод связываются с кислородом. Оба образуют длинные цепи, называемые полимерами. В простейшем случае углерод дает полимер под названием полиацеталь, пластик, используемый в синтетических волокнах и оборудовании. Кремний дает полимерные силиконы, которые используются для водонепроницаемой ткани или смазки металлических и пластиковых деталей.
Но когда углерод окисляется — или соединяется с кислородом, скажем, во время горения — он становится газообразным углекислым газом; силиций же окисляется до твердого диоксида, называемого кремнеземом. Кремний окисляется до твердого вещества. Это одна из основных причин того, почему он не может поддерживать жизнь.

Кремнезем или песок — это твердое вещество, диоксид кремния образует решетку, в которой один атом силиция окружен четырьмя атомами кислорода. Силикатные соединения, содержащие SiO4−4, также существуют в ряде минералов — полевых шпатах, слюде, цеолитах, тальке. И эти твердые системы создают проблемы в том, что касается утилизации энергии для живой системы.
Жизненная форма нуждается в некотором способе сбора, хранения и использования энергии. Она должна исходить из окружающей среды. После поглощения энергия должна высвобождаться именно там, где это необходимо, и в то время, когда это нужно. В противном случае вся она может высвобождать тепло одновременно, сжигая жизненную форму.
В мире на основе углерода основным элементом накопления являются углеводы, которые окисляются до воды и углекислого газа. Форма жизни на основе углерода «сжигает» энергию контролируемыми шагами, используя регуляторы скорости, называемые ферментами.
Интересные факты о кремнии
Этот элемент чрезвычайно распространен и очень широко используется. Но есть вещи, которые про него знают далеко не все:


- Когда астронавты Аполлона-11 приземлились на Луну в 1969 году, они оставили белый мешочек с кремниевым диском. Микроскопическим шрифтом там написано 73 сообщения на разных языках. Они выражают пожелания мира.
- Кремний может быть опасным. При вдыхании в течение длительных периодов времени это может вызвать заболевание легких, известное как силикоз.
- Переливчатость опала — результат присутствия кремния. Этот драгоценный камень — форма кремнезема, связанная с молекулами воды.
- Карбид кремния (SiC) почти такой же твердый, как алмаз. Он оценивается 9−9,5 по шкале твердости по Моосу, лишь немного меньше, чем самое крепкое вещество, которое имеет 10 баллов твердости.
- Растения используют кремний для укрепления клеточных стенок. Элемент является важным питательным веществом, которое помогает придать устойчивость к болезням. Об этом говорится в статье 1994 года, опубликованной в журнале Proceedings.
- Кремниевая долина получила свое название от вещества, используемого в компьютерных чипах. Название это впервые появилось в 1971 году в газете Electronic news. Своя Кремниевая долина есть не только в США, но и во многих других странах.
- Аморфная форма вещества также используется в радиоэлектронной технике.
У некоторых минералы и полудрагоценных камней строение основывается на диоксиде кремния. Они различаются плотностью и цветом:

- Аметист.
- Морион.
- Цитрин.
- Горный хрусталь.
- Опал.
- Агат.
- Сердолик.
- Яшма.
И другие камни.
Современные исследования
Сегодняшние разработки в области кремниевых технологий выглядят чуть ли не фантастично: в 2006 году исследователи объявили, что создали компьютерный чип, в котором кремниевые компоненты смешаны с клетками мозга. Это было действительно сенсационное открытие. Электрические сигналы от клеток мозга могут передаваться на электронные кремниевые компоненты чипа и наоборот. Есть надежда, что со временем получится создать устройства для лечения неврологических расстройств.

Исследование 2018 года, опубликованное в журнале Nature, было посвящено тестированию нового типа устройства из кремния, квантовых компьютеров, которые могут когда-нибудь стать обычной вещью, превосходя при этом современные компьютерные технологии в возможностях выполнять большое количество вычислений параллельно. Создание этих технологий с использованием тех же методов для изготовления традиционных кремниевых чипов может ускорить разработку этих устройств. Это может привести к новому этапу использования квантовых устройств.
Ученые также обещают создать невероятно маленькие лазеры, называемые наноиглами, которые могут использоваться для передачи данных быстрее и эффективнее, чем традиционные оптические кабели.

Сверхпроводниковые лазеры выделяют тепло гораздо легче, чем стеклянные, кремниевые лазеры могут похвастаться большей мощностью, чем традиционные, так заявляет Джон Баддинг, ученый-химик из Университета Пенсильвании.
Специалисты также работают над созданием оптических волокон следующего поколения, которые объединяют сверхпроводники, а не просто стекловолокно, так написано в журнале Live Science. В радиоэлектронной технике распространено применение силана, который получают при разложении силицида магния при помощи кислоты. Традиционные кремниевые чипы изготавливаются путем нанесения слоев элемента на плоскую поверхность, обычно начиная с газа-прекурсора силан (SiH4), поэтому новые разработки оптических волокон не потребуют нового дорогостоящего оборудования.
- https://PulsKamnya.ru/eto-nuzhno-znat/kremnij
- https://chemege.ru/silicium/
- https://mineralpro.ru/minerals/silicon/
- https://kamniinfo.ru/metally/kremniy-himiya-kremniya-i-ego-soedineniy-elektronnaya-konfiguratsiya-atoma-kremniya-si.html
- https://obrazovaka.ru/himiya/himicheskie-svoystva-kremniya.html
- https://habr.com/ru/post/152733/
- http://stroyres.net/metallicheskie/vidyi/vspomogatelnyie-veshhestva/kremniy.html
- https://TheMineral.ru/metally/kremnij
- https://medicina.dobro-est.com/kremniy-si-rol-v-organizme-simptomyi-nedostatka-istochniki.html
- https://nauka.club/khimiya/khimicheskiy-element-kremniy.html





