Содержание
- 1 История
- 2 Кадмий в таблице Менделеева
- 3 Распространение в природе
- 4 Запасы и месторождения
- 5 Строение атома
- 6 Изотопы
- 7 Характеристика простого вещества и промышленное получение металлического кадмия.
- 8 Соединения кадмия.
- 9 Плюсы и минусы
- 10 Получение
- 11 Свойства Кадмия
- 12 Где используется кадмий?
- 13 Применение
- 14 Опасность здоровью
История
Кадмий (лат. Cadmia,
греч. Kadmeia
означает цинковая руда)
был открыт в Германии в 1817 Фридрихом Штрогмеером. Штронгмеер нашел новый элемент в загрязнении оксида цинка, и около 100 лет Германия оставалась единственной страной, которая импортировала этот металл. Ученый назвал металл кадмием, подчеркнув его «родственные связи» с цинком: греческое слово «кадмия» означало «цинковая руда».
Кадмий в таблице Менделеева
Это элемент 5 периода 12 группы (или побочной подгруппы 2-й группы) периодической системы. Обозначение – Cd. Атомный (порядковый) номер – 48. Атомная масса – 112.
Принадлежит к группе переходных металлов. Кадмий – это представитель d-элементов.

Распространение в природе
Кадмий относится к числу редких рассеянных элементов, его Кларк (процент содержания по массе) в земной коре составляет 1,3 * 10 -5%. Для кадмия характерна миграция в горячих подземных водах вместе с цинком и другими халькофильных элементами (т.е. химическими элементами, склонными к образованию природных сульфидов, селенидов, телерадио, сульфосолей, что иногда встречаются в самородном состоянии) и концентрация в гидротермальных отложениях. Вулканические породы содержат до 0,2 мг кадмия на кг, среди осадочных пород наиболее богатые кадмием глины — до 0,3 мг / кг, известняки содержат 0,035 мг / кг, песчаники — 0,03 мг / кг. Среднее содержание кадмия в почве — 0,06 мг / кг.
Хотя известны самостоятельные минералы кадмия — гринокит (CdS), отавит (CdCO 3), монтепонит (CdO) и селенид (CdSe), своих залежей они не образуют, а присутствующие в виде примесей в цинковых, свинцовых, медных и полиметаллических рудах, и является основным источником промышленного получения кадмия.
В определенной степени кадмий присутствует и в воздухе. Содержание кадмия в воздухе составляет 0,1 -5 нг / м в сельской местности (1 нг или 10 -9 г), 2-15 нг / м — в городах и от 15 до 150 нг / м — в промышленных районах. Связано это с тем, что многие виды угля содержат кадмий в виде примесей и, при сжигания на теплоэлектростанциях, он попадает в атмосферу. При этом большая его часть оседает на почву. Также увеличению содержания кадмия в почве способствует использование минеральных удобрений, так как все они содержат незначительные примеси кадмия.
Кадмий может накапливаться в растениях (больше всего в грибах) и живых организмах (особенно в водных) и далее по пищевой цепи может «поставляться» человеку. Многие кадмия в сигаретном дыме.
Запасы и месторождения
Кадмий — редкий рассеянный элемент. Из него образуется ограниченное число соединений. Основным минералом, в котором содержится значительное количество этого элемента, является гринокит. Из него не образуются естественные скопления. Чаще данный минерал встречается в виде землянистой корки, которой покрываются цинковые минералы.
В больших количествах его добывают в зонах сульфидных месторождений. Самые большие из них расположены в Средней Азии, Казахстане, на Южном Урале.
Редкие минералы, которые могут содержать кадмий, — кадмоселит, отавит, монтепонит.
Строение атома
Конфигурация электронного облака – 1s22s22p63s23p63d104s24p64d105s2. По орбиталям электроны распределяются так: +48Cd)2)8)18)18)2.

Схематическое строение атома кадмия
Валентные электроны – те, которые располагаются на 4d и 5s электронных орбиталях. В основном состоянии энергетическая диаграмма имеет такой вид:
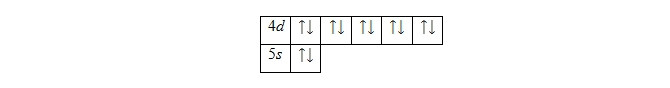
Ион этого элемента имеет вид 1s22s22p63s23p64s23d104p65s24d9.
Изотопы
Природный кадмиум состоит из 6 устойчивых изотопов. Было выявлено 27 устойчивых радиоизотопов: Cd-113 с периодом полураспада 7,7 квадриллионов лет, Cd-109 с периодом полураспада 462,6 дней и Cd-115 с периодом полураспада 53,46 часов. Все остальные радиоактивные изотопы имеют период полураспада менее 2,5 часов и большинство из них имеют период полураспада менее 5 минут. Этот элемент имеет 8 метастабильных состояний, самые стойкие из них: Cd-113 (t ½ 14,1 лет), Cd-115 (t ½ 44,6 дней) и Cd-117 (t ½ 3,36 часов).
Изотопы кадмия имеют атомную массу в пределах от 96,935 Дн (Cd-97) к 129,934 Дн (Cd-138). Основной вид распада наиболее распространенного устойчивого изотопа Cd-112 — это захват электрона и его бета-излучения. Продуктом распада к операции является элемент 47 (серебро), а после — элемент 49 (индий).
Характеристика простого вещества и промышленное получение металлического кадмия.
Кадмий – серебристое твердое вещество с голубоватым блеском на свежей поверхности, мягкий, ковкий, тягучий металл, хорошо прокатывается в листы, легко поддается полированию. Подобно олову палочки кадмия при сгибании издают треск. Плавится при 321,1° С, кипит при 766,5° С, плотность – 8,65 г/см3, что позволяет отнести его к тяжелым металлам.
В сухом воздухе кадмий устойчив. Во влажном воздухе он быстро тускнеет, а при нагревании легко взаимодействует с кислородом, серой, фосфором и галогенами. С водородом, азотом, углеродом, кремнием и бором кадмий не реагирует.
Пары кадмия взаимодействуют с парами воды с выделением водорода. Кислоты растворяют кадмий с образованием солей этого металла. Кадмий восстанавливает нитрат аммония в концентрированных растворах до нитрита аммония. Он окисляется в водном растворе катионами некоторых металлов, например меди(II) и железа(III). С растворами щелочей, в отличие от цинка, кадмий не взаимодействует.
Основные источники кадмия – промежуточные продукты цинкового производства. Осадки металлов, полученные после очистки растворов сульфата цинка действием цинковой пыли, содержат 2–12% кадмия. Во фракциях, образующихся при дистилляционном получении цинка, содержится 0,7–1,1% кадмия, а во фракциях, полученных при ректификационной очистке цинка – до 40% кадмия. Кадмий извлекают и из пыли свинцовых и медеплавильных заводов (она может содержать до 5% и 0,5% кадмия, соответственно). Пыль обычно обрабатывают концентрированной серной кислотой, а затем сульфат кадмия выщелачивают водой.
Из растворов сульфата кадмия действием цинковой пыли осаждают кадмиевую губку, затем ее растворяют в серной кислоте и очищают раствор от примесей действием оксида цинка или карбоната натрия, а также методами ионного обмена. Металлический кадмий выделяют электролизом на алюминиевых катодах либо восстановлением цинком.
Для удаления цинка и свинца металлический кадмий переплавляют под слоем щелочи. Расплав обрабатывают алюминием, чтобы удалить никель, и хлоридом аммония, чтобы избавиться от таллия. Применяя дополнительные методы очистки, можно получить кадмий с содержанием примесей 10–5% по массе.
В год производится около 20 тыс. т кадмия. Объем его производства в большой степени связан с масштабами производства цинка.
Важнейшей областью применения кадмия является производство химических источников тока. Кадмиевые электроды используются в батареях и аккумуляторах. Отрицательные пластины никель-кадмиевых аккумуляторов изготовлены из железных сеток с губчатым кадмием в качестве активного агента. Положительные пластины покрыты гидроксидом никеля. Электролитом служит раствор гидроксида калия. На основе кадмия и никеля изготавливают и компактные аккумуляторы для управляемых ракет, только в этом случае в качестве основы устанавливают не железные, а никелевые сетки.
Процессы, протекающие в никель-кадмиевом щелочном аккумуляторе, можно описать суммарным уравнением:
Cd + 2NiO(OH) + 2H2O Cd(OH)2 + 2Ni(OH)2
Никель-кадмиевые щелочные аккумуляторы более надежны, чем свинцовые (кислотные). Эти источники тока отличаются высокими электрическими характеристиками, стабильностью работы, длительным сроком эксплуатации. Их можно зарядить всего за один час. Однако никель-кадмиевые аккумуляторы нельзя подзаряжать без полной предварительной разрядки (в этом отношении они уступают металлогидридным аккумуляторам).
Кадмий широко используется для нанесения антикоррозионных покрытий на металлы, особенно в случаях их контакта с морской водой. Кадмируются наиболее важные детали кораблей, самолетов, а также различные изделия, предназначенные для работы в условиях тропического климата. Раньше железо и другие металлы кадмировали погружением изделий в расплавленный кадмий, сейчас кадмиевое покрытие наносят электролитически.
У кадмиевых покрытий есть некоторые преимущества по сравнению с цинковыми: они более устойчивы к коррозии, их легче сделать ровными и гладкими. Высокая пластичность таких покрытий обеспечивает герметичность резьбовых соединений. К тому же кадмий, в отличие от цинка, устойчив в щелочной среде.
Однако у кадмирования есть свои проблемы. При электролитическом нанесении кадмия на стальную деталь в металл может проникнуть содержащийся в электролите водород. Он вызывает у высокопрочных сталей так называемую водородную хрупкость, приводящую к неожиданному разрушению металла под нагрузкой. Для предотвращения этого явления в кадмиевые покрытия вводят добавку титана.
Кроме того, кадмий токсичен. Поэтому, хотя кадмированную жесть применяют довольно широко, для изготовления кухонной утвари и тары для пищевых продуктов использовать ее запрещено.
Примерно десятая часть мирового производства кадмия расходуется на производство сплавов. Кадмиевые сплавы используют главным образом как антифрикционные материалы и припои. Сплав, содержащий 99% кадмия и 1% никеля, применяют для изготовления подшипников, работающих в автомобильных, авиационных и судовых двигателях в условиях высоких температур. Поскольку кадмий недостаточно стоек к действию кислот, в том числе и содержащихся в смазочных материалах органических кислот, иногда подшипниковые сплавы на основе кадмия покрывают индием.
Легирование меди небольшими добавками кадмия позволяет делать более износостойкими провода на линиях электрического транспорта. Медь с добавкой кадмия почти не отличается по электропроводности от чистой меди, но заметно превосходит ее прочностью и твердостью.
Кадмий входит в легкоплавкого сплава Вуда (Wood’s metal), содержащего 50% висмута, 25% свинца, 12,5% олова, 12,5 % кадмия. Сплав Вуда можно расплавить в кипящей воде. Любопытно, что первые буквы компонентов сплава Вуда образуют аббревиатуру ВОСК. Он был изобретен в 1860 не очень известным английским инженером Б.Вудом (B.Wood). Часто это изобретение ошибочно приписывают его однофамильцу – знаменитому американскому физику Роберту Уильямсу Вуду, который родился лишь спустя восемь лет. Легкоплавкие сплавы кадмия используют как материал для получения тонких и сложных отливок, в автоматических противопожарных системах, для спайки стекла с металлом. Припои, содержащие кадмий, довольно устойчивы к температурным колебаниям.
Резкий скачок спроса на кадмий начался в 1940-е и был связан с применением кадмия в атомной промышленности – выяснилось, что он поглощает нейтроны и из него стали делать регулирующие и аварийные стержни атомных реакторов. Способность кадмия поглощать нейтроны строго определенных энергий используется при исследовании энергетических спектров нейтронных пучков.
Соединения кадмия.
Кадмий образует бинарные соединения, соли и многочисленные комплексные, в том числе металлоорганические, соединения. В растворах молекулы многих солей, в частности галогенидов, ассоциированы. Растворы имеют слабокислотную среду вследствие гидролиза. При действии растворов щелочей, начиная с рН 7–8, осаждаются основные соли.
Оксид кадмия CdO получают при взаимодействии простых веществ или прокаливанием гидроксида либо карбоната кадмия. В зависимости от «термической истории» он может быть зеленовато-желтым, коричневым, красным или почти черным. Это частично обусловлено размером частиц, но в большей степени является результатом дефектов кристаллической решетки. Выше 900° С оксид кадмия летуч, а при 1570° С полностью возгоняется. Он обладает полупроводниковыми свойствами.
Оксид кадмия легко растворяется кислотах и плохо – в щелочах, легко восстанавливается водородом (при 900° С), монооксидом углерода (выше 350° С), углеродом (выше 500° С).
Оксид кадмия используют в качестве материала электродов. Он входит в состав смазочных масел и шихты для получения специальных стекол. Оксид кадмия катализирует ряд реакций гидрогенизации и дегидрогенизации.
Гидроксид кадмия Cd(OH)2 выпадает в виде белого осадка из водных растворов солей кадмия(II) при добавлении щелочи. При действии очень концентрированных растворов щелочей он превращается в гидроксокадматы, такие как Na2[Cd(OH)4]. Гидроксид кадмия реагирует с аммиаком с образованием растворимых комплексов:
Cd(OH)2 + 6NH3·H2O = [Cd(NH3)6](OH)2 + 6H2O
Кроме того, гидроксид кадмия переходит в раствор под действием цианидов щелочных элементов. Выше 170° С он разлагается до оксида кадмия. Взаимодействие гидроксида кадмия с пероксидом водорода в водном растворе приводит к образованию пероксидов разнообразного состава.
Применяют гидроксид кадмия для получения других соединений кадмия, а также как аналитический реагент. Он входит в состав кадмиевых электродов в источниках тока. Кроме того, гидроксид кадмия используется в декоративных стеклах и эмалях.
Фторид кадмия CdF2 мало растворим в воде (4,06% по массе при 20° С), не растворим в этаноле. Его можно получить действием фтора на металл или фтороводорода на карбонат кадмия.
Фторид кадмия используется в качестве оптического материала. Он входит в состав некоторых стекол и люминофоров, а также твердых электролитов в химических источниках тока.
Хлорид кадмия CdCl2 хорошо растворим в воде (53,2% по массе при 20° С). Его ковалентный характер обусловливает сравнительно низкую температуру плавления (568,5° С), а также растворимость в этаноле (1,5% при 25° С).
Хлорид кадмия получают при взаимодействии кадмия с концентрированной соляной кислотой или хлорированием металла при 500° С.
Хлорид кадмия является компонентом электролитов в кадмиевых гальванических элементах и сорбентов в газовой хроматографии. Он входит в состав некоторых растворов в фотографии, катализаторов в органическом синтезе, флюсов для выращивания полупроводниковых кристаллов. Его используют как протраву при крашении и печатании тканей. Из хлорида кадмия получают кадмиеорганические соединения.
Бромид кадмия CdBr2 образует чешуйчатые кристаллы с перламутровым блеском. Он очень гигроскопичен, хорошо растворим в воде (52,9% по массе при 25° С), метаноле (13,9% по массе при 20° С), этаноле (23,3% по массе при 20° С).
Получают бромид кадмия бромированием металла или действием бромоводорода на карбонат кадмия.
Бромид кадмия служит катализатором в органическом синтезе, является стабилизатором фотоэмульсий и компонентом вирирующих составов в фотографии.
Иодид кадмия CdI2 образует блестящие кристаллы в виде листочков, у них слоистая (двумерная) кристаллическая структура. Известно до 200 политипов иодида кадмия, различающихся последовательностью расположения слоев с гексагональной и кубической плотнейшей упаковкой.
В отличие от других галогенов, иодид кадмия не гигроскопичен. Он хорошо растворяется в воде (46,4% по массе при 25° С). Получают иодид кадмия иодированием металла при нагревании или в присутствии воды, а также действием иодоводорода на карбонат или оксид кадмия.
Иодид кадмия служит катализатором в органическом синтезе. Он является компонентом пиротехнических составов и смазочных материалов.
Сульфид кадмия CdS был, вероятно, первым соединением этого элемента, которым заинтересовалась промышленность. Он образует кристаллы от лимонно-желтого до оранжево-красного цвета. Сульфид кадмия обладает полупроводниковыми свойствами.
В воде это соединение практически не растворяется. К действию растворов щелочей и большинства кислот он также устойчив.
Получают сульфид кадмия взаимодействием паров кадмия и серы, осаждением из растворов под действием сероводорода или сульфида натрия, реакциями между кадмий- и сераорганическими соединениями.
Сульфид кадмия – важный минеральный краситель, раньше его называли кадмиевой желтью.
В малярном деле кадмиевая желть впоследствии стала применяться шире. В частности, ею красили пассажирские вагоны, потому что, помимо прочих достоинств, эта краска хорошо противостояла паровозному дыму. Как красящее вещество сульфид кадмия использовали также в текстильном и мыловаренном производствах. Соответствующие коллоидные дисперсии применяли для получения цветных прозрачных стекол.
В последние годы чистый сульфид кадмия вытесняется более дешевыми пигментами – кадмопоном и цинкокадмиевым литопоном. Кадмопон – смесь сульфида кадмия и сульфата бария. Его получают, смешивая две растворимые соли – сульфат кадмия и сульфид бария. В результате образуется осадок, содержащий две нерастворимые соли:
CdSO4 + BaS = CdSЇ + BaSO4Ї
Цинкокадмиевый литопон содержит еще и сульфид цинка. При изготовлении этого красителя в осадок выпадают одновременно три соли. Литопон – кремового цвета или цвета слоновой кости.
С добавками селенида кадмия, сульфида цинка, сульфида ртути и других соединений сульфид кадмия дает термически устойчивые пигменты с яркой окраской от бледно-желтой до темно-красной.
Сульфид кадмия придает пламени синюю окраску. Это его свойство используют в пиротехнике.
Кроме того, сульфид кадмия применяется как активная среда в полупроводниковых лазерах. Он случит в качестве материала для изготовления фотоэлементов, солнечных батарей, фотодиодов, светодиодов, люминофоров.
Селенид кадмия CdSe образует темно-красные кристаллы. Он не растворяется в воде, разлагается соляной, азотной и серной кислотами. Получают селенид кадмия сплавлением простых веществ или из газообразных кадмия и селена, а также осаждением из раствора сульфата кадмия под действием селеноводорода, реакцией сульфида кадмия с селенистой кислотой, взаимодействием между кадмий- и селенорганическими соединениями.
Селенид кадмия является люминофором. Он служит в качестве активной среды в полупроводниковых лазерах, является материалом для изготовления фоторезисторов, фотодиодов, солнечных батарей.
Селенид кадмия является пигментом для эмалей, глазурей и художественных красок. Селенидом кадмия окрашивают рубиновое стекло. Именно он, а не оксид хрома, как в самом рубине, сделал рубиново-красными звезды московского Кремля.
Теллурид кадмия CdTe может иметь окраску от темно-серой до темно-коричневой. Он не растворяется в воде, но разлагается концентрированными кислотами. Его получают взаимодействием жидких или газообразных кадмия и теллура.
Обладающий полупроводниковыми свойствами теллурид кадмия используют как детектор рентгеновского и g-излучения, а теллурид ртути-кадмия нашел широкое применение (особенно в военных целях) в ИК детекторах для тепловидения.
При нарушении стехиометрии или введении примесей (например, атомов меди и хлора), теллурид кадмия приобретает светочувствительные свойства. Это используется в электрофотографии.
Кадмиеорганические соединения CdR2 и CdRX (R = CH3, C2H5, C6H5 и другие углеводородные радикалы, Х – галогены, OR, SR и др.) обычно получают из соответствующих реактивов Гриньяра. Они термически менее устойчивы, чем их цинковые аналоги, однако в целом менее реакционноспособны (обычно не воспламеняются на воздухе). Их наиболее важной областью применения является получение кетонов из хлорангидридов кислот.
Плюсы и минусы
| Достоинства кадмированных изделий | Недостатки |
| Отлично проявляют себя в среде, содержащей Cl (например, морской воде) | Бесполезно кадмировать изделия, работающие в присутствии серы и ее соединений |
| Обладают высокой пластичностью | Сварка разрушает кадмиевые покрытия |
| Допускается сопряжение с оксидированным алюминием и цинком | Кадмий и его соединения опасны для здоровья |
Получение
Мировое производство кадмия в начале XXI в. составляет ок. 20 млн т. Из них страны Азии дают 45%, Америки — 25%, Европы — 27%.
Основные источники кадмия — промежуточные продукты цинкового производства, пыль свинцовых и медеплавильных заводов. Сырье обрабатывают концентрированной серной кислотой и получают CdSO 4 в растворе. Из раствора Cd выделяют, используя цинковая пыль:
Полученный металл очищают переплавкой под слоем щелочи для удаления примесей цинка и свинца. Кадмий высокой чистоты получают электрохимическим рафинированием с промежуточным очисткой электролита.
Свойства Кадмия

Кадмий относится к переходным металлам. Он мягкий, тягучий и ковкий.
Характеристики:
- Кристаллическая структура решетки гексагональная.
- У элемента рекордная для металлов теплопроводность в области абсолютного нуля.
- Цвет белый, серебристый.
Кадмий тяжелый металл, наряду с осмием, свинцом, молибденом.
Имеет три модификации; отличить их можно некоторым физическим параметрам.
Химические свойства:
- Оксиды и сульфиды кадмия почти не растворяются в воде.
- В условиях влажного воздуха на поверхности образуется оксидная пленка. Она препятствует дальнейшему окислению.
- Не образует карбидов.
- В нагретых разбавленных H2SO4 и HNO3 (формулы серной и соляной кислот) кадмий растворяется с выделением водорода.
| Ка́дмий / Cadmium (Cd), 48 |
| 112,411(8)[1] а. е. м. (г/моль) |
| [Kr] 4d10 5s2 |
| 154 пм |
| 148 пм |
| (+2e) 97 пм |
| 1,69 (шкала Полинга) |
| −0,403[2] |
| 2 |
| 867,2 (8,99) кДж/моль (эВ) |
| 8,65 г/см³ |
| 594,1 K (321 °C) |
| 1038 K (764,85 °C) |
| 6,11 кДж/моль |
| 59,1 кДж/моль |
| 26,0[2] Дж/(K·моль) |
| 13,1 см³/моль |
| гексагональная |
| a=2,979 c=5,618 Å |
| 1,886 |
| 209 K |
| (300 K) 96,9 Вт/(м·К) |
| 7440-43-9 |
Рекомендуем: РТУТЬ — «кровь дракона» в лампах и реакторах
Физические свойства
Кадмий — это мягкий, тягучий, гибкий, серебристо-белый двухвалентный металл, который можно легко разрезать. Во многом он похож на цинк, но он способен образовывать сложные соединения.
Химические свойства
По химическим свойствам кадмий подобный цинка, однако менее активным. При обычной температуре на воздухе поверхность металлического кадмия покрывается оксидной пленкой, которая затрудняет проведение реакций — большинство взаимодействий проходят при нагревании. При сжигании кадмия в струе кислорода образуется его оксид:
При контакте с водой кадмий пассивируется за появления гидроксидних пленки Cd (OH) 2, однако он активно разлагает перегретый водную пару:
Кроме кислорода, металлический кадмий взаимодействует также с галогенами, серой, селеном, фосфором (с образованием примесей):
Восстановительные свойства в кадмия слабее, чем в цинке, но он так же восстанавливает некоторые неметаллы из оксидов и металлы в их солях (в растворах):
Кадмий может выступать в качестве комплексообразователя, координируя 3, 4 или 6 лигандов:
Электронная схема кадмия
Cd: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10
Короткая запись:
Cd: [Kr]5s2 4d10
You need to enable JavaScript to run this app.
Одинаковую электронную конфигурацию имеют
атом кадмия и
+1In, +2Sn, +3Sb, +4Te, +5I, +6Xe
Порядок заполнения оболочек атома кадмия (Cd) электронами:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d →
5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на
‘d’ — до 10 и на ‘f’ до 14
Кадмий имеет 48 электронов,
заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
10 электронов на 3d-подуровне
6 электронов на 4p-подуровне
2 электрона на 5s-подуровне
10 электронов на 4d-подуровне
Степень окисления кадмия
Атомы кадмия в соединениях имеют степени окисления 2, 1.
Степень окисления — это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Ионы кадмия
2+Cd
1+Cd
Cd 0
Валентность Cd
Атомы кадмия в соединениях проявляют валентность II, I.
Валентность кадмия характеризует способность атома Cd к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Cd
Квантовые числа определяются последним электроном в конфигурации,
для атома Cd эти числа имеют значение N = 4, L = 2, Ml = -2, Ms = ½
Видео заполнения электронной конфигурации (gif):
Результат:
Механические
Свойства:
- Металл соединяют с цирконием, цинком для получения сплавов с улучшенными характеристиками.
- Для увеличение механических свойств сплав дополняется редкоземельными металлами, которые выступают в роли легированных добавок.
- Твердость по системе Бринелля — 20 НВ.
Где используется кадмий?
Сферы применения:
- Изготовление пигментов. Используются соли металла.
- Применение в качестве реактива для проведения экспериментов.
- Производство батарей, аккумуляторов.
- Применение в качестве легирующей добавки для сплавов.
- Изготовление регулирующих стержней в атомной промышленности. С их помощью можно изменять скорость атомных реакций.
- Производство солнечных батарей, полупроводников, стабилизаторов для ПВХ, люминофоров, зубных пломб.
- Изредка находит применение при сборке криотехники.
- Изготовление ювелирных украшений. Используется в соединении с золотом.
Поскольку металл может накапливаться в раковых клетках, его применяют при лечении онкологических заболеваний.
Применение
Благодаря своим физическим свойствам, кадмий нашел широкое применение в технике и промышленности (особенно, начиная с 50-х годов XX века). Основные сферы применения его использования: для антикоррозионного покрытия (так называемого кадмирования) черных металлов, особенно в тех случаях, когда они контактируют с морской водой, а также для производства никель-кадмиевых электрических аккумуляторов и батарей. Кадмий входит в состав многих сплавов, как лекгоплавких, применяемых в качестве припоев (например, сплав Вуда (Wood»s metal) — 50% Bi, 25% Pb, 12,5% Sn, 12,5% Cd), так и тугоплавких износостойких (например, с никелем). Кадмий используется в стержнях-замедлителях атомных реакторов, некоторые соединения кадмия имеют полупроводниковые свойства и тому подобное. Достаточно долго кадмий использовался для производства красителей (пигментов) и в качестве стабилизатора в производстве пластмасс (например, полихлорвинила), однако в настоящее время, из-за токсичности, в этих целях он практически не используется.
Сплавы
Кадмий используется как компонент твёрдых припоев (сплавов на основе серебра, меди, цинка) для снижения их температуры плавления. Около 10 % производимого кадмия — компонент ювелирных и легкоплавких сплавов. Сплав кадмия с золотом — единственный металлический сплав зелёного цвета. Сплав кадмия с вольфрамом, рением и 0,15 % урана 235 — небесно-голубого цвета был получен испанскими учеными в 1998 году.
Защитные покрытия
40 % производимого кадмия используется для нанесения антикоррозионных покрытий на металлы.
Химические источники тока
Около 20 % кадмия идет на изготовление кадмиевых электродов, применяемых в аккумуляторах (никель-кадмиевых и серебряно-кадмиевых), нормальных элементах Вестона, в резервных батареях (свинцово-кадмиевый элемент, ртутно-кадмиевый элемент и др.
Пигменты
Около 20 % кадмия используется для производства неорганических красящих веществ (сульфиды и селениды, смешанные соли, например, сульфид кадмия — кадмий лимонный).
Медицина
- Иногда кадмий применяется в экспериментальной медицине.
Кадмий используется в гомеопатической медицине
- В последние годы кадмий стал применяться при создании новых противоопухолевых нано-медикаментов. В России в начале 1950-х годов были проведены первые успешные эксперименты, связанные с разработкой противоопухолевых медикаментов на основе соединений кадмия.
Другие сферы применения
- Сульфид кадмия применяется для производства плёночных солнечных батарей с КПД около 10—16 %, а также как очень хороший термоэлектрический материал.
- Кадмий используется как компонент полупроводниковых материалов и люминофоров.
- Кадмий очень хорошо захватывает тепловые нейтроны и служит для изготовления регулирующих стержней для атомных реакторов и в качестве защиты от нейтронов. Иногда эти свойства используются в экспериментальных моделях противоопухолевой терапии Neutron Capture Therapy
- Фтороборат кадмия — важный флюс, применяемый для пайки алюминия и других металлов.
- Теплопроводность кадмия вблизи абсолютного нуля наивысшая среди всех металлов, поэтому кадмий иногда применяется для криогенной техники.
Опасность здоровью
Кадмий — один из немногих элементов, не выполняет конструктивных функций в человеческом организме. Этот элемент и его соединения являются чрезвычайно токсичными даже в незначительных концентрациях. Имеет свойство накапливаться в организмах и экосистемах.
Вдыхание кадмиевого пыли быстро приводит к заболеваниям, часто смертельных, дыхательных путей и почек (чаще всего — почечная недостаточность). Поглощение любой значительного количества кадмия вызывает немедленное поражение печени и почек. Соединения, содержащие кадмий также канцерогенными. Данные о канцерогенности кадмия ограничены. В опытах на животных не было зафиксировано роста числа опухолей из употребления кадмия. Такая тенденция наблюдалась только с вдыханием частиц пыли, содержащий неорганические соединения кадмия.
Отравление кадмием является причиной болезни, которая впервые была описана в Японии в 50-х годах XX века и получила название «Итай-итай» (что дословно означает «больно-больно»).
Токсичен ли кадмий
Этот химический элемент может попасть в организм с табачным дымом, дорожной пылью. Он находится в дыме теплоэлектростанций, дыме, образующегося после сжигания дров. Любители пива рискуют получить некоторую дозу элемента, потому что его добавляют в напиток для повышения пенообразования.
Японские ученые доказали, что у людей, которые проживают на территориях, загрязненных солями Cd, обнаруживается высокая ломкость костей. Впервые эта болезнь была замечена у фермеров, которые применяли воду с цинковой шахты для орошения рисового поля. Поразительно, но с рисом каждую неделю в организм человека поступало до 4 мг металла (в 8 раз больше предельной нормы).
Вещество угнетает активность ферментов, поражает нервную систему, печень, почки. Хроническая интоксикация приводит к развитию анемии. Пары оксидов и чистого металла токсичны: вдыхание на протяжении полуминуты воздуха с концентрацией паров 5 граммов на кубический метр оказывает смертельное влияние на организм. Острое отравление сопровождается рвотой и судорогами.

- https://slovarslov.ru/kadmii-metall-ili-nemetall-smotret-chto-takoe-kadmii-v-drugih-slovaryah.html
- https://uchim.guru/himiya/kadmij.html
- https://metalloy.ru/metally/kadmiy
- https://www.krugosvet.ru/enc/nauka_i_tehnika/himiya/KADMI.html
- https://TheMineral.ru/metally/kadmij
- https://k-tree.ru/tools/chemistry/periodic.php?element=Cd
- http://himsnab-spb.ru/article/ps/cd/





