Содержание
- 1 История
- 2 Названия
- 3 Нахождение в природе
- 4 Изотопы
- 5 Электронная схема ванадия
- 6 Особенности строения атома
- 7 Химические свойства ванадия:
- 8 Физические свойства ванадия:
- 9 Получение и применение металла
- 10 Марки ванадия и сплавов
- 11 Прокат ванадия
- 12 Достоинства / недостатки
- 13 Добыча: из руды, асцидий и мухоморов
- 14 Полезные свойства ванадия и его влияние на организм
История
Ванадий был открыт в 1801 году профессором минералогии из Мехико Андресом Мануэлем Дель Рио в свинцовых рудах. Он обнаружил новый металл и предложил для него название «панхромий» из-за широкого диапазона цвета его соединений, сменив затем название на «эритроний». Дель Рио не имел авторитета в научном мире Европы, и европейские химики усомнились в его результатах. Затем и сам Дель Рио потерял уверенность в своём открытии и заявил, что открыл всего лишь хромат свинца.
В 1830 году ванадий был открыт заново шведским химиком Нильсом Сефстрёмом в железной руде. Новому элементу название дали Берцелиус и Сефстрём.
Шанс открыть ванадий был у Фридриха Вёлера, исследовавшего мексиканскую руду, но он серьёзно отравился фтороводородом незадолго до открытия Сефстрёма и не смог продолжить исследования. Однако Вёлер довёл до конца исследование руды и окончательно доказал, что в ней содержится именно ванадий, а не хром.
Названия
Этот элемент образует соединения с красивой окраской, отсюда и название элемента, связанное с именем скандинавской богини любви и красоты Фрейи (др.-сканд. Vanadís — дочь Ванов; Ванадис). В 1831 году геолог Шаблон:Iwq предложил переименовать ванадий в «риониум», но это предложение не было поддержано.
Нахождение в природе
Ванадий является 20-м наиболее распространённым элементом в земной коре. Он относится к рассеянным элементам и в природе в свободном виде не встречается. Содержание ванадия в земной коре 1,6⋅10−2% по массе, в воде океанов 3⋅10−7%. Наиболее высокие средние содержания ванадия в магматических породах отмечаются в габбро и базальтах (230—290 г/т). В осадочных породах значительное накопление ванадия происходит в биолитах (асфальтитах, углях, битуминозных фосфатах), битуминозных сланцах, бокситах, а также в оолитовых и кремнистых железных рудах. Близость ионных радиусов ванадия и широко распространённых в магматических породах железа и титана приводит к тому, что ванадий в гипогенных процессах целиком находится в рассеянном состоянии и не образует собственных минералов. Его носителями являются многочисленные минералы титана (титаномагнетит, сфен, рутил, ильменит), слюды, пироксены и гранаты, обладающие повышенной изоморфной ёмкостью по отношению к ванадию. Важнейшие минералы: патронит V(S2)2, ванадинит Pb5(VO4)3Cl и некоторые другие. Основной источник получения ванадия — железные руды, содержащие ванадий как примесь.
Ванадил ион () в изобилии находится в морской воде, имеющий среднюю концентрацию 30 нМа. Некоторые источники минеральной воды также содержат ион в высоких концентрациях. Например, источники около горы Фудзи содержат до 54 мкг на литр.
Изотопы
Если говорить о распространенности рассматриваемого атома в природе, то ванадий — химический элемент, который относится к рассеянным. Он входит в состав практически всех крупных горных пород, руд и минералов. Но нигде его не бывает больше 2%.
Содержание в земной коре значительно и составляет 1,9*10-7. По этому показателю он стоит впереди меди, цинка, свинца. Собственные горные породы металл не формирует, однако существует несколько месторождений, которые считаются именно ванадиевыми. В них содержится железо, в кристаллическую решетку которого встроены атомы ванадия в большом количестве.
Это такие породы, как:
- ванадинит;
- патронит;
- карнотит;
- чилеит.
Также можно встретить рассматриваемый металл в составе:
- золы растений;
- океанской воды;
- тел асцидий, голотурий;
- организмов наземных растений и животных.
Если говорить об изотопах ванадия, то их всего два: с массовым числом 51, которого подавляющее большинство — 99,77%, и с массовым числом 50, который является рассеянным радиоактивным и встречается в ничтожных количествах.

Электронная схема ванадия
V: 1s2 2s2 2p6 3s2 3p6 4s2 3d3
Короткая запись:
V: [Ar]4s2 3d3
Одинаковую электронную конфигурацию имеют атом ванадия и -1Ti, +2Mn, +3Fe, +4Co
Порядок заполнения оболочек атома ванадия (V) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на ‘d’ — до 10 и на ‘f’ до 14
Ванадий имеет 23 электрона, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
3 электрона на 3d-подуровне
Особенности строения атома
Ванадий — химический элемент, строение атома которого выражается общей электронной формулой 3d34s2. Очевидно, что благодаря такой конфигурации и валентности, и степени окисления могут проявлять неодинаковые значения.
Данная формула позволяет предсказать свойства ванадия как простого вещества — это типичный металл, образующий большое количество различных соединений, в том числе комплексных.

Химические свойства ванадия:
| 300 | Химические свойства | |
| 301 | Степени окисления | -3, -1, 0, +1, +2, +3, +4, +5 |
| 302 | Валентность | II, III, IV, V |
| 303 | Электроотрицательность | 1,63 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 650,91 кДж/моль (6,746187(21) эВ) |
| 305 | Электродный потенциал | V3+ + e— → V2+, Eo = -0,255, V3+ + 3e— → V, Eo = -0,255, V2+ + 2e— → V, Eo = -0,255, |
| 306 | Энергия сродства атома к электрону | 50,6 кДж/моль |
Ионы ванадия
5+V
4+V
3+V
2+V
1+V
V 01-V
2-V
Валентность V
Атомы ванадия в соединениях проявляют валентность V, IV, III, II, I.
Валентность ванадия характеризует способность атома V к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа V
Квантовые числа определяются последним электроном в конфигурации, для атома V эти числа имеют значение N = 3, L = 2, Ml = 0, Ms = ½
Соединения ванадия
Выше мы уже указывали на то, что как химический элемент данный металл проявляет достаточную активность, чтобы сформировать большое количество различных соединений. Так, известны следующие типы веществ с участием ванадия.
- Оксиды.
- Гидроксиды.
- Бинарные соли (хлориды, фториды, бромиды, сульфиды, йодиды).
- Оксисоединения (оксихлориды, оксибромиды, окситрифториды и прочие).
- Комплексные соли.

Так как валентность элемента варьируется достаточно широко, то и веществ получается немало. Главная отличительная особенность всех их — это окраска. Ванадий — химический элемент, разбор соединений которого показывает, что цвет может колебаться от белого и желтого до красного и синего, включая оттенки зеленого, оранжевого, черного и фиолетового. Отчасти именно это послужило причиной, по которой дали название атому, ведь это действительно выглядит очень красиво.
Однако многие из соединений получаются лишь при достаточно жестких условиях проведения реакции. Кроме того, большинство из них — токсичные, опасные для человека вещества. Агрегатное состояние веществ может быть самым разным. Например, хлориды, бромиды и фториды — чаще всего темно-розовые, зеленые или черные кристаллы. А оксиды — в виде порошков.
Галогениды ванадия
Кратко отметим, что единственный галогенид, отвечающий составу (ce{VHal5}), — это фторид (ce{VF5}). Максимально возможная степень окисления в хлориде и бромиде — +4, в иодиде — +3. Все галогениды ванадия в степенях окисления ниже максимально возможных получены, сводная таблица представлена на рисунке ниже:
Ванадий: сульфат
В добавках для здоровья используют не просто ванадий, а производное от него вещество – сульфат ванадия. Именно он содержится в пище и усваивается организмом человека. Чистый элемент применяется в промышленной сфере. Сульфат ванадия представляет соединение соли ванадия и серной кислоты. Химическая формула – VSO4.
Физические свойства ванадия:
| 400 | Физические свойства | |
| 401 | Плотность* | 6,11 г/см3 (при 0 °C/20 °C и иных стандартных условиях, состояние вещества – твердое тело), 5,5 г/см3 (при температуре плавления 1910 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления* | 1910 °C (2183 K, 3470 °F) |
| 403 | Температура кипения* | 3407 °C (3680 K, 6165 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 21,5 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 444 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,502 Дж/г·K (при 20-100 °C) |
| 410 | Молярная теплоёмкость* | 24,89 Дж/(K·моль) |
| 411 | Молярный объём | 8,35 см³/моль |
| 412 | Теплопроводность | 30,7 Вт/(м·К) (при стандартных условиях), 30,7 Вт/(м·К) (при 300 K) |
| 413 | Коэффициент теплового расширения | 8,4 мкм/(М·К) (при 25 °С) |
| 414 | Коэффициент температуропроводности | |
| 415 | Критическая температура | |
| 416 | Критическое давление | |
| 417 | Критическая плотность | |
| 418 | Тройная точка | |
| 419 | Давление паров (мм.рт.ст.) | |
| 420 | Давление паров (Па) | |
| 421 | Стандартная энтальпия образования ΔH | |
| 422 | Стандартная энергия Гиббса образования ΔG | |
| 423 | Стандартная энтропия вещества S | |
| 424 | Стандартная мольная теплоемкость Cp | |
| 425 | Энтальпия диссоциации ΔHдисс | |
| 426 | Диэлектрическая проницаемость | |
| 427 | Магнитный тип | |
| 428 | Точка Кюри | |
| 429 | Объемная магнитная восприимчивость | |
| 430 | Удельная магнитная восприимчивость | |
| 431 | Молярная магнитная восприимчивость | |
| 432 | Электрический тип | |
| 433 | Электропроводность в твердой фазе | |
| 434 | Удельное электрическое сопротивление | |
| 435 | Сверхпроводимость при температуре | |
| 436 | Критическое магнитное поле разрушения сверхпроводимости | |
| 437 | Запрещенная зона | |
| 438 | Концентрация носителей заряда | |
| 439 | Твёрдость по Моосу | |
| 440 | Твёрдость по Бринеллю | |
| 441 | Твёрдость по Виккерсу | |
| 442 | Скорость звука | |
| 443 | Поверхностное натяжение | |
| 444 | Динамическая вязкость газов и жидкостей | |
| 445 | Взрывоопасные концентрации смеси газа с воздухом, % объёмных | |
| 446 | Взрывоопасные концентрации смеси газа с кислородом, % объёмных | |
| 446 | Предел прочности на растяжение | |
| 447 | Предел текучести | |
| 448 | Предел удлинения | |
| 449 | Модуль Юнга | |
| 450 | Модуль сдвига | |
| 451 | Объемный модуль упругости | |
| 452 | Коэффициент Пуассона | |
| 453 | Коэффициент преломления |
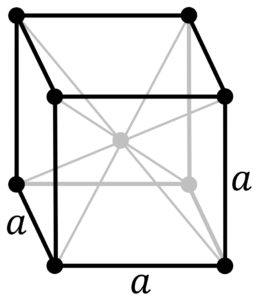
Кристаллическая решётка ванадия:
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая объёмно-центрированная
|
| 513 | Параметры решётки | 3,024 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 390 K |
| 516 | Название пространственной группы симметрии | Im_ 3m |
| 517 | Номер пространственной группы симметрии | 229 |
Степень окисления ванадия
Атомы ванадия в соединениях имеют степени окисления 5, 4, 3, 2, 1, 0, -1, -2.
Степень окисления — это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Получение и применение металла
Получают ванадий, выделяя его из горных пород и руд. Причем те минералы, которые содержат даже 1% металла, считаются чрезвычайно богатыми на ванадий. После отделения образца смеси железа и ванадия его переводят в концентрированный раствор. Из него выделяют подкислением ванадат натрия, из которого в дальнейшем получают сильно концентрированный образец, с содержанием металла до 90%.
Затем этот высушенный осадок прокаливают в печи и восстанавливают ванадий до металлического состояния. В таком виде материал готов к использованию.
Ванадий — химический элемент, который находит достаточно широкое применение в промышленности. Особенно в машиностроении и выплавке сплавов из стали. Можно определить несколько основных областей использования металла.
- Текстильная промышленность.
- Стекловарение.
- Производство керамики и резины.
- Лакокрасочная промышленность.
- Получение и синтез химических веществ (сернокислое производство).
- Изготовление ядерных реакторов.
- Авиационное и кораблестроение, машиностроение.
Ванадий — очень важный легирующий компонент для получения легких, прочных, устойчивых к коррозии сплавов, в основном стали. Не зря его называют «автомобильным металлом».
Марки ванадия и сплавов
Применение в промышленном производстве находит как чистый металл, так и сплавы на его основе.
- ВЭЛ-1, ВЭЛ-2, ВЭЛ-3, — чистый ванадий, содержащий до 99,84% V, полученный электролитическим способом; поставляется в виде порошка.
- ВнМ-1, ВнМ-2 — чистый V в виде слитков, полученных электронно-дуговой плавкой; содержание V составляет до 99,34% и 99,04% соответственно.
- ВнП-1, ВнП-2 — чистый ванадий в виде прутков круглого сечения.
- ВнПр-1, ВнПр-2 — чистый V в виде проволоки.
- ВнПл-1, ВнПл-2 — чистый V в виде полос.
- ВВ-8 — сплав ванадий-вольфрам с 6-8% W.
Промышленный выпуск чистого металла
Металлический ванадий реализуется в двух физических состояниях: твердом – куски и порошкообразном. Слитки ванадия изготавливают методом выплавки внутри электроннолучевых печей. Это современная установка, оборудованная двумя видами пушек: термоэлектронные и ВТР. Непосредственно рабочий процесс получения слитков, происходит согласно технологии капельной плавки в охлаждаемый водой кристаллизатор. Он изготовлен из меди и устанавливается вертикально.
По степени чистоты различают три марки ванадия в слитках:
- ВнМ-0 – 99,99;
- ВнМ-1 – 99,9;
- ВнМ-2 – 99.5.
Все они производятся согласно ТУ 48-4-272-73, обладают цилиндрической формой с габаритами по длине: 20 – 80 см; и диаметру 80, 100, 120 и 150 мм. Вес бруска колеблется от 8 до 80 кг.
Порошкообразный металл изготавливается посредством электролитического рафинирования. В качестве исходного сырья выступает алюминотермический V. Результирующий электролитический порошок ванадия также имеет три степени чистоты, определяемых его маркой:
- Вэл-1 – 99.9;
- Вэл-2 – 99.7;
- Вэл-3 – 99.5.
Исходный кусковой металлический ванадий, получаемый алюминотермической технологией, характеризуется более низкой чистотой. Его состав: V – свыше 95%, Al менее 2% и Fe до 0.3%.
Прокат ванадия
Сегодня, металл доступен не только слитками, кусками или порошком. Ванадий купить реально в виде изделий проката, производимых согласно ТУ 48-4-373-76. Основные виды реализации – это:
- лист ванадия;
- пруток;
- трубчатый профиль.
Аналогично слиткам, проволока из ванадия также выпускается тремя сортами ВнПр-0, 1 и 2. Их чистота аналогична соответствующим маркам металла в слитках. Наряду с прутками, проволокой, а также листовым прокатом, высоким спросом пользуется трубка из ванадия.
Полоса ванадия выпускается двух марок ВнПл-1 и ВнПл-2, отличающихся степенью чистоты базового металла. Листовая продукция металла отличается оригинальность исполнения. Например, лента ванадия имеет широкую вариацию по ширине и толщине, а также обладает закругленными краями в целях безопасности. Дополнительно, ленточный прокат может иметь специальное покрытие под эксплуатацию в неблагоприятных климатических условиях.
Достоинства / недостатки
- Достоинства:
- имеет высокую температуру плавления;
- имеет хорошие технологические и механические свойства — хорошая пластичность и свариваемость, прочность;
- имеет меньшую стоимость по сравнению с другими металлами со схожими характеристиками.
- Недостатки:
- относительно небольшой процент содержания в земной коре.
Добыча: из руды, асцидий и мухоморов
Основными месторождениями владеют:
- Китай;
- ЮАР;
- США;
- Россия;
- Армения.

Лидером в производстве ванадия является Китай, он и диктует цены на металл.
Интересно: японцы ярко продемонстрировали русскую пословицу «голь на выдумки хитра». Изобретательные жители Страны восходящего солнца на специальных морских плантациях разводят асцидий (морские хордовые). Эти животные содержат ванадия больше, чем многие его руды. А несчастных асцидий сжигают и из пепла извлекают лакомый металл.
Некоторые мухоморы тоже очень богаты ванадием. Так что и в наших лесах можно открывать добычу ценного элемента.
Полезные свойства ванадия и его влияние на организм
Ванадий играет заметную роль в регулировании липидного и углеводного обмена, принимает участие в активной выработке энергии. Медики отмечают, что уменьшение уровня холестерина связано с количеством поступающего в организм ванадия. Является стимулирующим фактором для движения кровяных клеток, которые поглощают болезнетворные микробы (фаоцитов).
Признаки нехватки ванадия
Дефицит ванадия представлен единичными случаями ванадийдефицитной шизофрении, а также связан с патологией углеводного обмена.
Признаки избытка ванадия
Избыток ванадия значительно более распространен и связан с производством асфальта, стекла, топливной продукции (мазут, бензин, и т.д.). Обладает гипертензивным действием (ВОЗ, 1997). Установлена связь генеза маниакально-депрессивных состояний и невротической реактивной депрессии с повышением уровня ванадия в крови. Описана ванадиевая природа эндемичного рассеянного склероза — жирорастворимые комплексы ванадия техногенного происхождения кумулируются в миелиновых оболочках и в коре мозга, приводя к развитию рассеянного склероза.
- https://chem.ru/vanadij.html
- https://FB.ru/article/196380/vanadiy-himicheskiy-element-istoriya-nazvaniya-stroenie-atoma-valentnost
- https://k-tree.ru/tools/chemistry/periodic.php?element=V
- https://ChemicalStudy.ru/vanadiy-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
- https://chemtoday.ru/data/chemistry/vanadium/
- https://herbhelp.ru/vanadij/
- https://www.metotech.ru/vanadiy-opisanie.htm
- https://xlom.ru/spravochnik/vanadij-opisanie-primenenie-cena-vanadiya-za-kg
- https://TheMineral.ru/metally/vanadij
- https://calorizator.ru/element/v