Содержание
- 1 Магний
- 2 Особенности Mg, как элемента периодической системы
- 3 История
- 4 Атом и молекула магния. Формула магния. Строение магния
- 5 Получение чистого металла
- 6 Свойства магния (таблица): температура, плотность, давление и прочее
- 7 Электронная схема магния
- 8 Степень окисления магния
- 9 Ионы магния
- 10 Валентность Mg
- 11 Кристаллическая решётка магния:
- 12 Квантовые числа Mg
- 13 Энергия ионизации
- 14 Взаимодействие с различными кислотами
- 15 Нахождение в природе
- 16 Применение
- 17 Значение для человека
- 18 Магний металлический цена за килограмм
Магний
Mg 12 Магний
24,304-24,307 1s2 2s2 2p6 3s2
Магний — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 12. Расположен во 2-й группе (по старой классификации — главной подгруппе второй группы), третьем периоде периодической системы.
Особенности Mg, как элемента периодической системы
Химические свойства магния во многом лежат где-то между бериллием и кальцием. Прежде всего, это проявляется во взаимодействии с водой. Первый не реагирует с ней вообще, второй же в ней растворяется. Mg слабо взаимодействует с нагретой водой. Но при взаимодействии с водяным паром (от 400 градусов по Цельсию) происходит реакция Mg+ H2O = MgO + H2, в которой металл растворяется при активном выделении водорода.
Видео – химические свойства магния:
Несколько иная реакция происходит с водяным паром: Mg+ 2H2O = Mg(OH)2 +H2. Причем свободный водород в итоге поглощается магнием MgH3. В результате, если плавление металла происходило во влажной среде, по мере его застывания водород практически полностью исчезает.
Свойства магния: взаимодействовать с водой при высоких температурах становится и гореть при присутствии в атмосфере углекислого газа, – затрудняют тушение пожаров с участием Mg. Их нельзя тушить водой. По инструкции используют порошковые огнетушители и песок. Также можно применять оксиды Si, с которыми магний вступает в реакцию, но количество выделяемой теплоты значительно ниже.

На фото: горение магния
Также необходимо отметить, что несмотря на фактическую нерастворимость Mg(OH)2 в воде, раствор фенолфталеина в его присутствии окрашивается в розовый цвет.

Магний в таблице Менделеева
Магний металл устойчив к едким щелочам, соде, керосину, бензину, минеральным маслам. Способность этого элемента отнимать кислород и хлор, используют для восстановления чистых веществ. Например, брома или титана.
Для синтезов разных классов органических соединений используется свойство магния взаимодействовать с галогенами. Обычно это Cl, Br, I, с фтором Mg образует защитную пленку, из-за чего их соединение редко используется для синтеза реактивов Гриньяра. Последние наиболее часто формируются на основе формулы RMgHal, где R – это органический радикал, а Hal – один из перечисленных галогенов.
История
С рудой в 18 – начале 19 века экспериментировали ученые Европы. Получать удавалось лишь сильно загрязненное вещество.
Настоящая история открытия начинается с середины 19 века, когда француз А.Бюсси и англичанин М.Фарадей получили материал достаточной степени чистоты. Оба использовали расплавленный хлорид магния. Первый восстанавливал вещество металлическим калием, второй – электролизом.
История названия вещества восходит ко временам Малой Азии. Магнезией назывался город, вблизи которого обнаружились залежи магнезита.
В России с середины 19 века используется термин «магний».
Атом и молекула магния. Формула магния. Строение магния
Магний (лат. Magnesium, от др.-греч. βαρύς – «тяжёлый») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Mg и атомным номером 12. Расположен в 2-й группе (по старой классификации — главной подгруппе второй группы), третьем периоде периодической системы.
Магний – щёлочноземельный металл. Относится к группе цветных металлов.
Как простое вещество магний при нормальных условиях представляет собой лёгкий, ковкий металл серебристо-белого цвета.
Молекула магния одноатомна.
Химическая формула магния Mg.
Электронная конфигурация атома магния 1s2 2s2 2p6 3s2. Потенциал ионизации (первый электрон) атома магния равен 737,75 кДж/моль (7,646236(4) эВ).
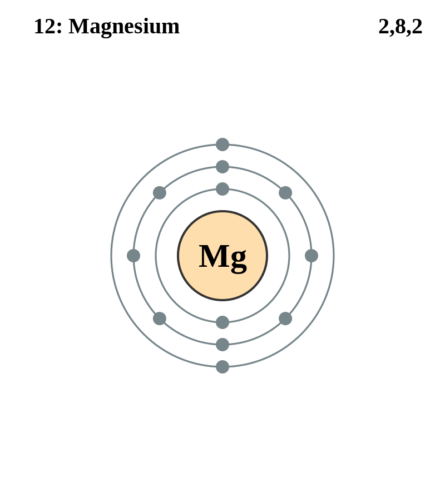
Строение атома магния. Атом магния состоит из положительно заряженного ядра (+12), вокруг которого по трем атомным оболочкам движутся 12 электронов. При этом 10 электронов находятся на внутреннем уровне, а 2 электрона – на внешнем. Поскольку магний расположен в третьем периоде, оболочек всего три. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома магния – на 3s-орбитали находится два спаренных электрона. В свою очередь ядро атома магния состоит из 12 протонов и 12 нейтронов. Магний относится к элементам s-семейства.
Радиус атома магния (вычисленный) составляет 145 пм.
Атомная масса атома магния составляет 24,304-24,307 а. е. м.
Получение чистого металла
Промышленное получение металла возможно двумя способами:
- Электролитическим.
- Термическим.
В первом способе необходимы обезвоженные хлориды магния, натрия, калия. Их смешивают в электролитической ванне, в расплаве происходит восстановления магния.
Чистый металл сливают, добавляя в ванну сырье. В черновом металле содержится до 2% примесей. При необходимости еще не остывший магний рафинируют, доводя чистоту почти до идеальной — 99,999%.
Во втором способе в качестве сырья предпочтительно использовать доломит с добавлением кокса. Возможно использование морской воды. Смесь разогревают до 2100 градусов, пары магния отгоняются и конденсируются.
Производство магниевых сплавов
Выплавку литейных магниевых сплавов производят:
- в тигельных печах, работающих на жидком топливе, на газообразном топливе, на электричестве;
- в электрических индукционных печах;
- в отражательных печах.
Выплавку деформируемых магниевых сплавов производят:
- в отражательных печах (3-12 т);
- в индукционных печах (более 12 т).
Во время выплавки магниевого сплава его поверхность усиленно защищают слоем флюса, чтобы не было контакта с кислородом. Применяются флюсы, изготовленные на основе солей фтора и хлора, а также щелочных металлов. В формовочные смеси также вводят специальные присадки чтобы избежать горения сплава.
Дальнейшую обработку литейных сплавов производят способами:
- литьё в песчаные формы – изготовление отливок методом заливки металла в специально подготовленные литейные модели, где будущие пустоты изделия заполняются песком;
- литьё в кокиль – изготовление отливок в разборных формах, пригодных к многократному употреблению;
- литьё под давлением – изготовление отливок путём впрыскивания металла в форму под давлением.
Дальнейшую обработку деформируемых сплавов производят способами:
- прессования – обработки сплава давлением путём выдавливания его из закрытой полости;
- ковки – обработки сплава давлением посредством приложения к нему высокой ударной нагрузки;
- штамповки – обработка сплава давлением посредством направленной пластической деформации;
- горячей прокатки – обработка сплав давлением путём пропускания его между давящими валками при высоких температурах;
- холодной прокатки – обработка сплав давлением путём пропускания его между давящими валками при низких температурах.
Способы обработки готовых изделий для улучшения их механических показателей:
- закалка (гомогенизация);
- закалка со искусственным старением;
- отжиг на снятие механических напряжений (рекристаллизация);
- отжиг на выравнивание структуры металла и на снижение зернистости (диффузный).
Свойства магния (таблица): температура, плотность, давление и прочее
| 100 | Общие сведения | |
| 101 | Название | Магний |
| 102 | Прежнее название | |
| 103 | Латинское название | Magnesium |
| 104 | Английское название | Magnesium |
| 105 | Символ | Mg |
| 106 | Атомный номер (номер в таблице) | 12 |
| 107 | Тип | Металл |
| 108 | Группа | Цветной, щёлочноземельный металл |
| 109 | Открыт | Джозеф Блэк, Шотландия, 1755 г., Хемфри Дэви, Великобритания, 1808 г., Антуан Александр Брутус Бюсси, Франция, 1829 г. |
| 110 | Год открытия | 1755 г. |
| 111 | Внешний вид и пр. | Лёгкий, ковкий, серебристо-белый металл |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 2,9 % |
| 120 | Содержание в морях и океанах (по массе) | 0,13 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,06 % |
| 122 | Содержание в Солнце (по массе) | 0,07 % |
| 123 | Содержание в метеоритах (по массе) | 12 % |
| 124 | Содержание в организме человека (по массе) | 0,027 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса)* | 24,304-24,307 а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 |
| 203 | Электронная оболочка | K2 L8 M2 N0 O0 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 145 пм |
| 205 | Эмпирический радиус атома* | 150 пм |
| 206 | Ковалентный радиус* | 141 пм |
| 207 | Радиус иона (кристаллический) | Mg2+ 71 (4) пм, 86 (6) пм, Читайте также: Надфиль — инструмент для тонких работ 103 (8) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 173 пм |
| 209 | Электроны, Протоны, Нейтроны | 12 электронов, 12 протонов, 12 нейтронов |
| 210 | Семейство (блок) | элемент s-семейства |
| 211 | Период в периодической таблице | 3 |
| 212 | Группа в периодической таблице | 2-ая группа (по старой классификации – главная подгруппа 2-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | |
| 302 | Валентность | II |
| 303 | Электроотрицательность | 1,31 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 737,75 кДж/моль (7,646236(4) эВ) |
| 305 | Электродный потенциал | Mg2+ + 2e– → Mg, Eo = -2,363 В |
| 306 | Энергия сродства атома к электрону | 50 кДж/моль |
| 400 | Физические свойства | |
| 401 | Плотность | 1,738 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), 1,584 г/см3 (при температуре плавления 650 °C и иных стандартных условиях, состояние вещества – жидкость), 1,57 г/см3 (при 651 °C и иных стандартных условиях, состояние вещества –жидкость) |
| 402 | Температура плавления | 650 °C (923 K, 1202 °F) |
| 403 | Температура кипения* | 1091 °C (1363 K, 1994 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 8,48 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 128 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,983 Дж/г·K (при 25 °C), 1,6 Дж/г·K (при 100 °C), 1,31 Дж/г·K (при 650 °C) |
| 410 | Молярная теплоёмкость* | 24,869 Дж/(K·моль) |
| 411 | Молярный объём | 14,0 см³/моль |
| 412 | Теплопроводность | 156 Вт/(м·К) (при стандартных условиях), 156 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Гексагональная плотноупакованная
|
| 513 | Параметры решётки | a = 3,2029 Å, c = 5,2000 Å |
| 514 | Отношение c/a | 1,624 |
| 515 | Температура Дебая | 318 К |
| 516 | Название пространственной группы симметрии | P63/mmc |
| 517 | Номер пространственной группы симметрии | 194 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7439-95-4 |
Примечание:
- 201* Указан диапазон значений атомной массы в связи с различной распространённостью изотопов данного элемента в природе.
- 205* Эмпирический радиус атома магния согласно [1] составляет 160 пм.
- 206* Ковалентный радиус магния согласно [1] и [3] составляет 141±7 пм и 136 пм соответственно.
- 403* Температура кипения магния согласно [3] составляет 1090 °C (1363 K, 1994 °F).
- 407* Удельная теплота плавления (энтальпия плавления ΔHпл) магния согласно [3] составляет 9,20 кДж/моль.
- 408* Удельная теплота испарения (энтальпия кипения ΔHкип) магния согласно [3] составляет 131,8 кДж/моль.
- 410* Молярная теплоемкость магния согласно [3] составляет 24,90 Дж/(K·моль).
Физические свойства
Магний — очень легкий, довольно хрупкий металл, постепенно окисляется на воздухе, превращаясь в белый оксид магния. Кристаллическая решетка α-формы Ca (устойчивой при обычной температуре) гранецентрированная кубическая, а = 5,56Å. Атомный радиус 1,97Å, ионный радиус Ca2+, 1,04Å. Плотность 1,74 г/см³(20 °C). Выше 464 °C устойчива гексагональная β-форма. tпл = 650 °C, tкип = 1105 °C; температурный коэффициент линейного расширения 22•10-6 (0-300 °C); теплопроводность при 20 °C 125,6 Вт/(м•К) или 0,3 кал/(см•сек•°C); удельная теплоемкость (0-100 °C) 623,9 дж/(кг•К) или 0,149 кал/(г•°C); удельное электросопротивление при 20 °C 4,6•10-8 ом•м или 4,6•10-6ом•см; температурный коэффициент электросопротивления 4,57•10-3 (20 °C). Модуль упругости 26 Гн/м² (2600 кгс/мм²); предел прочности при растяжении 60 Мн/м² (6 кгс/мм²); предел упругости 4 Мн/м² (0,4 кгс/мм²), предел текучести 38 Мн/м² (3,8 кгс/мм²); относительное удлинение 50 %; твердость по Бринеллю 200—300 Мн/м² (20-30 кгс/мм²). Магний достаточно высокой чистоты пластичен, хорошо прессуется, прокатывается и поддается обработке резанием.
Фазовый переход в сверхпроводящее состояние
При температуре Тс= 0,0005 К магний (Mg) переходит в сверхпроводящее состояние.
Химические свойства
Смесь порошкового магния с перманганатом калия KMnO4 — взрывчатое вещество! Раскаленный магний реагирует с водой:
Mg (раск.) + Н2О = MgO + H2;
Щелочи на магний не действуют, в кислотах он растворяется легко с выделением водорода:
Mg + 2HCl = MgCl2 + H2;
При нагревании на воздухе магний сгорает, с образованием оксида, также с азотом может образовываться небольшое количество нитрида:
2Mg + О2 = 2MgO;
3Mg + N2 = Mg3N2
Электронная схема магния
Mg: 1s2 2s2 2p6 3s2
Короткая запись:
Mg: [Ne]3s2
Одинаковую электронную конфигурацию имеют атом магния и -1Na, +1Al, +2Si, +3P, +4S, +5Cl
Порядок заполнения оболочек атома магния (Mg) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на ‘d’ — до 10 и на ‘f’ до 14
Магний имеет 12 электронов, заполним электронные оболочки в описанном выше порядке:
- 2 электрона на 1s-подуровне
- 2 электрона на 2s-подуровне
- 6 электронов на 2p-подуровне
- 2 электрона на 3s-подуровне
Степень окисления магния
Атомы магния в соединениях имеют степени окисления 2.
Степень окисления — это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Ионы магния
2+Mg
Mg 0
Валентность Mg
Атомы магния в соединениях проявляют валентность II.
Валентность магния характеризует способность атома Mg к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Кристаллическая решётка магния:
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Гексагональная плотноупакованная
|
| 513 | Параметры решётки | a = 3,2029 Å, c = 5,2000 Å |
| 514 | Отношение c/a | 1,624 |
| 515 | Температура Дебая | 318 К |
| 516 | Название пространственной группы симметрии | P63/mmc |
| 517 | Номер пространственной группы симметрии | 194 |
Квантовые числа Mg
Квантовые числа определяются последним электроном в конфигурации,
для атома Mg эти числа имеют значение N = 3, L = 0, Ml = 1, Ms = -½
Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать. Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo. Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии ионизации для каждого последующего электрона.
Энергия ионизации Mg:
Eo = 738 кДж/моль
Взаимодействие с различными кислотами
Для краткости, проще рассмотреть несколько экспериментов. Для них берутся такие виды кислот:
- Соляная.
- Азотная.
- Серная (разбавленная и нет).

В первом случае наблюдается практически мгновенное растворение, сопровождающееся пузырьками белых газов и резким запахом хлора. Емкость, в которой происходила реакция нагревается.
В азотной кислоте кусочек магния не тонет. Бурый газ скапливается над поверхностью жидкости, выделяется тепло. Иногда говорят, что кислота «кипела», окружая кусочки магния.
Третий случай необходимо рассматривать, как два частных. В неразбавленной серной кислоте реакция идет медленно. Если же использовать раствор с небольшим количеством воды, магний также, как с азотной кислотой плавает на поверхности. При этом происходит едва заметная реакция с выделением белых пузырьков газа.
Нахождение в природе
Кларк магния — 1,95 % (19,5 кг/т). Это один из самых распространённых элементов земной коры. Большие количества магния находятся в морской воде в виде раствора солей. Основные минералы с высоким массовым содержанием магния:
- морская вода — (0,12—0,13 %),
- карналлит — MgCl2 • KCl • 6H2O (8,7 %),
- бишофит — MgCl2 • 6H2O (11,9 %),
- кизерит — MgSO4 • H2O (17,6 %),
- эпсомит — MgSO4 • 7H2O (9,9 %),
- каинит — KCl • MgSO4 • 3H2O (9,8 %),
- магнезит — MgCO3 (28,7 %),
- доломит — CaCO3·MgCO3 (13,1 %),
- брусит — Mg(OH)2 (41,6 %).
Магнезиальные соли встречаются в больших количествах в солевых отложениях самосадочных озёр. Месторождения карналлита осадочного происхождения имеются во многих странах.
Магнезит образуется преимущественно в гидротермальных условиях и относящихся к среднетемпературным гидротермальным месторождениям. Доломит также является важным магниевым сырьём. Месторождения доломита широко распространены, запасы их огромны. Они генетически связаны с карбонатными осадочными слоями и большинство из них имеет докембрийский или пермский геологический возраст. Доломитовые залежи образуются осадочным путём, но могут возникать также при воздействии на известняки гидротермальных растворов, подземных или поверхностных вод.
Чрезвычайно редким минералом является самородный магний, образующийся в потоках восстановительных газов и впервые обнаруженный в 1991 году в береговых отложениях Чоны (Восточная Сибирь), а затем в лавах в Южном Гиссаре (Таджикистан).
Природные источники магния
- Ископаемые минеральные отложения (магнезиальные и калийно-магнезиальные карбонаты: доломит, магнезит).
- Морская вода.
- Рассолы (рапа соляных озёр).
В 1995 г. бо́льшая часть мирового производства магния была сосредоточена в США (43 %), странах СНГ (26 %) и Норвегии (17 %), на рынке возрастает доля Китая.
Минералы, месторождения
Наш герой настолько активен в химическом отношении (просто-таки «неразборчив в связях»), что его нахождение в природе в чистом виде практически невозможно.
Природные источники магния — минералы:
- брусит;
- кизерит;
- доломит;
- магнезит;
- бишофит;
- эпсомит;
- карналлит.
Даже из морской воды можно добывать огненный металл. Самосадочные озера (вода в них называется рапой), содержат большое количество минеральных солей, в том числе магния.
Познавательно: таких озер много в Астраханской области. Это Белинские, Зинзилинские, Мочаговские самосадочные озера (список можно продолжить).
Крупнейшая российская группа месторождений — Саткинское — (разведано 14 штук) находится в Челябинской области, рядом с городом Сатка. Тут сосредоточены магнезиальные руды высокой чистоты.
Применение
Сплавы
Сплавы на основе магния являются важным конструкционным материалом в авиационной и автомобильной промышленности благодаря их лёгкости и прочности. Цены на магний в слитках в 2006 году составили в среднем 3 долл/кг.
Химические источники тока
Магний в виде чистого металла, а так же его химические соединения (бромид, перхлорат) применяются для производства очень мощных резервных электрических батарей (например магний-перхлоратный элемент, серно-магниевый элемент, хлористосвинцово-магниевый элемент, хлорсеребряно-магниевый элемент, хлористомедно-магниевый элемент, магний-ванадиевый элемент и др), и сухих элементов (марганцево-магниевый элемент, висмутисто-магниевый элемент, магний-м-ДНБ элемент и др). ХИТ на основе магния отличаются очень высокими значениями удельных энергетических характеристик и высоким разрядным напряжением. В последние годы в ряде стран обострилась проблема разработки аккумулятора с большим сроком службы, так как теоретические данные позволяют утверждать очень большие перспективы его широкого использования (высокая энергия, экологичность, доступность сырья).
Соединения
Гидрид магния — один из наиболее емких аккумуляторов водорода, применяемых для его хранения.
Огнеупорные материалы
Оксид магния MgO применяется в качестве огнеупорного материала для производства тиглей и специальной футеровки металлургических печей.
Перхлорат магния, Mg(ClO4)2 — (ангидрон) применяется для глубокой осушки газов в лабораториях, и в качестве электролита для химических источников тока с участием магния.
Фторид магния MgF2 — в виде синтетических монокристаллов применяется в оптике (линзы, призмы).
Бромид магния MgBr2 — в качестве электролита для химических резервных источников тока.
Медицина
Оксид и соли магния применяется в медицине (аспаркам, сульфат магния, цитрат магния, минерал бишофит). Бишофитотерапия использует биологические эффекты природного магния в лечении и реабилитации широкого круга заболеваний, в первую очередь — опорно-двигательного аппарата, нервной и сердечно-сосудистой систем.
Фотография
Магниевый порошок с окисляющими добавками (нитрат бария, нитрат аммония, перманганат калия, гипохлорит натрия, хлорат калия и т. д.) применялся (и применяется сейчас в редких случаях) в фотоделе в химических фотовспышках (магниевая фотовспышка).
Польза и вред добавок
Чистый магний ковкий, легкий металл. Только есть у металла свойство — подверженность коррозии. Потому чистый металл используют редко, в отличие от его сплавов. Для сплавов магния очень важны добавки алюминия, циркония, цинка.
Алюминий делает сплав прочнее и удобнее для литейных работ.
Количество лигатуры важно для качеств сплава:
- 3% алюминия придадут наибольшую пластичность;
- 6% лигатуры — даст лучшие прочность и пластичность;
- 9% алюминия подарит сплаву максимальную прочность.
Свойства цинка в сплавах подобны алюминиевым:
- 3% добавка максимально увеличивает пластичность;
- 5% цинка даст гармоничное сочетание пластичности и прочности сплава;
Если в сплаве есть вредные примеси (никель, железо), то лигатура цинка повысит коррозионную стойкость.
Кремний повысит способность к литью, но в присутствии железа уменьшит устойчивость к ржавчине.
Никель и железо примеси вредные, они делают сплав подверженным ржавчине.
Сплавы магния делят на деформируемые (МА) и литейные (МЛ); последние применяются значительно чаще. В сплав МЦИ добавляют медь, железо, цинк, никель. Эта смесь металлов хороша при вибронагрузках.
Значение для человека
Магний изначально присутствует в биологических организмах. Однако в повседневных продуктах (хлеб, молоко, мясо) его минимум.
Жизненные процессы
Без металла невозможен нормальный ход важных жизненных процессов:
- Синтез белка.
- Работа нервной системы, сердечной мышцы.
- Расширение сосудов.
- Желчеотделение.
- Работа ЖКТ.
- Выведение из организма холестерина.
- Сокращение мышц.
Суточная норма вещества для женщин и мужчин – 300 и 400 мг.
Потребность увеличивают психические, физические перегрузки, стрессы, злоупотребление алкоголем, потливость.
Нужно учитывать, что организм усваивает лишь треть общего количества поступившего вещества.
Усваивать микроэлемент полнее мешают фитин, жирный или насыщенный кальцием рацион.
Токсикология
Соединения магния малотоксичны (за исключением солей таких ядовитых кислот, как синильная, азотистоводородная, плавиковая, хромовая).
Биологическая роль
Магний — один из важных биогенных элементов, в значительных количествах содержится в тканях животных и растений (хлорофиллы). Его биологическая роль сформировалась исторически в период зарождения и развития протожизни на нашей планете в связи с тем, что солевой состав морской воды древней Земли был преимущественно хлоридно-магниевый, в отличие от нынешнего — хлоридно-натриевого.
Магний является кофактором многих ферментативных реакций. Магний необходим для превращения креатинфосфата в АТФ — нуклеотид, являющийся универсальным поставщиком энергии в живых клетках организма. Магний необходим на всех этапах синтеза белка. Он участвует в поддержании нормальной функции нервной системы и мышцы сердца, оказывает сосудорасширяющее действие, стимулирует желчеотделение, повышает двигательную активность кишечника, что способствует выведению из организма холестерина.
Усвоению магния мешают наличие фитина и избыток жиров и кальция в пище. Недостаток магния в организме может проявляться по-разному: бессонница, хроническая усталость, остеопороз, артрит, фибромиалгия, мигрень, мышечные судороги и спазмы, сердечная аритмия, запоры, предменструальный синдром (ПМС). При потливости, частом употреблении слабительных и мочегонных, алкоголя, больших психических и физических нагрузках (в первую очередь при стрессах и у спортсменов) потребность в магнии увеличивается.
Более всего магния содержится в пшеничных отрубях, тыквенных семечках, какао-порошке. К пище, богатой магнием относят также кунжут, отруби, орехи. Однако обилие фитина в этих продуктах делает его малодоступным для усвоения, поэтому только зелёные овощи могут служить надёжным источником магния. Магния совсем мало в хлебе, молочных, мясных и других повседневных продуктах питания современного человека. Суточная норма магния — порядка 300 мг для женщин и 400 мг для мужчин (предполагается, что всасывается около 30 % магния).
При употреблении витаминно-минеральных комплексов, содержащих магний, необходимо помнить, что при чрезмерном его потреблении возможна передозировка, сопровождающаяся снижением артериального давления, тошнотой, рвотой, угнетением центральной нервной системы, снижением рефлексов, изменениями на электрокардиограмме, угнетением дыхания, комой, остановкой сердца, параличом дыхания, анурическим синдромом.
Также следует соблюдать осторожность при приеме магния людям с почечной недостаточностью.
Питание
Магнием насыщены порошковое какао, отруби, орехи, тыквенные семечки. Однако усваивать элемент мешает изобилие в них фитина.
Кладезем магния диетологи считают зеленые овощи. Это капуста, огурцы, горошек, спаржа, сельдерей, лук, шпинат, петрушка.
Последствия дефицита или избытка вещества
Симптомы дефицита магния:
Читайте также: Как приготовить столярный клей по дереву в гранулах или костный (казеиновый) и склеить деревянные детали свойми руками
- Проблемы с костями (артрит, остеопороз).
- Судороги, спазмы мышц.
- Головная боль.
- Сбои в работе ЖКТ (запоры), сердца (аритмия).
На эмоциональном плане нехватка вещества приводит к бессоннице, перманентной усталости, раздражительности (особенно ПМС).
Опасно и чрезмерное увлечение микроэлементом.
О передозировке металла сигнализируют:
- Снижение артериального давления.
- Тошнота, рвота.
- Угнетение ЦНС, рефлекторной функции, дыхания.
Дело может закончиться комой, параличом дыхательных путей, сердечной мышцы.
Магний металлический цена за килограмм
Не все пункты приема принимают магний. У тех, кто принимает существует лишь одна категория этого металла – кусковой лом магния (точнее это даже не магний в чистом виде, а сплавы, в которых он содержится, но в пунктах обозначается, как лом магния), его стоимость (средняя) составляет:
Лом магния кусковой – 38 рублей за килограмм.
В домашнем обиходе лом магния – это различные вешалки, дверные ручки. Лом магния можно встретить в виде старых блоков цилиндров от двигателей, карсасов авто сидений, панелей приборов, картеров сцепления и коробки передач, педалей, а также поддона картера двигателя, крышки головки блока цилиндров, впускного коллектора.

Так выглядит лом магния
Не стоит путать лом магния с ломом ЦАМа.
Широкий спектр применения этого элемента в металлургии, медицине, агропромышленном комплексе делает его интересным, в качестве вторичного сырья.
Однако увидеть объявления с желанием купить магний с ценой за кг лома, приходится довольно редко. Чаще востребованы сплавы и сернокислый порошок Mg. Но это не мешает бирже оценивать магний металл, цена которого зависит от выпуска чистого продукта. Периодически выпуск снижается, тогда таблоиды показывают возрастание стоимости продукта.
В пунктах приема лом магния и цена на него может зависеть от условий, на которых происходит факт купли/продажи – цена может варьироваться незначительно и от его объема.
Интерес к материалу подогревается его высокой огнеупорностью. Благодаря этому свойству Mg участвует в производстве футеровок и тиглей для металлургических печей.
- https://met-lit.ru/stanki/mg-eto-metall.html
- https://xlom.ru/spravochnik/magnij-xarakteristika-metalla-magniya-ego-primeneniya-svojstva-i-cena
- https://TheMineral.ru/metally/magnij
- http://himsnab-spb.ru/article/ps/mg/
- https://chem.ru/magnij.html
- https://k-tree.ru/tools/chemistry/periodic.php?element=Mg
- https://ChemicalStudy.ru/magniy-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/