Содержание
- 1 Происхождение названия
- 2 История
- 3 Нахождение в природе
- 4 Добыча и производство
- 5 Химические свойства хрома
- 6 Электронная схема хрома
- 7 Степень окисления хрома
- 8 Ионы хрома
- 9 3+Валентность Cr
- 10 Квантовые числа Cr 3+
- 11 Основные характеристики
- 12 Применение
- 13 Марки хрома и сплавов
- 14 Достоинства / недостатки
- 15 Роль в биологии
- 16 Меры предосторожности
Происхождение названия
Название элемент получил от греч. χρῶμα — цвет, краска — из-за разнообразия окраски своих соединений.
История
Открыт на Среднем Урале, в Березовском золоторудном месторождении. Впервые упоминается в труде М. В. Ломоносова «Первые основания металлургии» (1763 год), как красная свинцовая руда, PbCrO4. Современное название — крокоит. В 1797 году французский химик Л. Н. Воклен выделил из него новый тугоплавкий металл (скорее всего, Воклен получил карбид хрома).
Нахождение в природе
Хром является довольно распространённым элементом в земной коре (0,012 % по массе). Основные соединения хрома — хромистый железняк (хромит) FeO·Cr2O3. Вторым по значимости минералом является крокоит PbCrO4.
Добыча и производство
Элемент производят из хромита (FeCr2O4). Примерно половина этой руды в мире добывается в Южной Африке. Кроме того, Казахстан, Индия и Турция являются его крупными производителями. Разведанных месторождений хромита достаточно, но географически они сконцентрированы в Казахстане и на юге Африки.
Залежи самородного металлического хрома встречаются редко, но они есть. Например, его добывают на шахте «Удачная» в России. Она является кимберлитовой трубкой, богатой алмазами, и восстановительная среда помогла образоваться чистому хрому и алмазам.
Для промышленного производства металла хромитовые руды обрабатывают расплавленной щелочью (едким натром, NaOH). При этом образуется хромат натрия (Na2CrO4), который восстанавливается углеродом до оксида Сг2O3. Металл получают при нагревании окисла в присутствии алюминия или кремния.
В 2000 году было добыто около 15 млн т хромитовой руды, которая была переработана в 4 млн т феррохрома, на 70% состоящего из сплава хрома с железом, приблизительная рыночная стоимость которых составила 2,5 млрд долларов США.

Месторождения
Самые большие месторождения хрома находятся в ЮАР (1-е место в мире), Казахстане, России, Зимбабве, Мадагаскаре. Также есть месторождения на территории Турции, Индии, Армении, Бразилии, на Филиппинах.
Главные месторождения хромовых руд в РФ известны на Урале (Донские и Сарановское).
Разведанные запасы в Казахстане составляют свыше 350 миллионов тонн (2-е место в мире).
Химические свойства хрома
При обычных условиях хром реагирует только со фтором. При высоких температурах (выше 600°C) взаимодействует с кислородом, галогенами, азотом, кремнием, бором, серой, фосфором.
4Cr + 3O2 –t° →2Cr2O3
2Cr + 3Cl2 –t°→ 2CrCl3
2Cr + N2 –t°→ 2CrN
2Cr + 3S –t°→ Cr2S3
В раскалённом состоянии реагирует с парами воды:
2Cr + 3H2O → Cr2O3 + 3H2
Хром растворяется в разбавленных сильных кислотах (HCl, H2SO4)
В отсутствии воздуха образуются соли Cr2+, а на воздухе – соли Cr3+.
Cr + 2HCl → CrCl2 + H2
2Cr + 6HCl + O2 → 2CrCl3 + 2H2O + H2
Наличие защитной окисной плёнки на поверхности металла объясняет его пассив-ность по отношению к концентрированным растворам кислот – окислителей.
Электронная схема хрома
Cr: 1s2 2s2 2p6 3s2 3p6 4s1 3d5 →
Cr3+: 1s22s22p63s23p64s03d3
You need to enable JavaScript to run this app.
Порядок заполнения оболочек атома хрома (Cr3+) электронами:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d →
5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на
‘d’ — до 10 и на ‘f’ до 14
Хром имеет 24 электрона,
заполним электронные оболочки в описанном выше порядке:
Элемент Cr является исключением!
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
3 электрона на 3d-подуровне
Степень окисления хрома
Атомы хрома в соединениях имеют степени окисления 6, 5, 4, 3, 2, 1, 0, -1, -2, -3, -4.
Степень окисления — это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Степень окисления иона Cr3+ = 3
Ионы хрома
6+Cr
5+Cr
4+Cr
Cr 3+2+Cr
1+Cr
0Cr
1-Cr
2-Cr
3-Cr
4-Cr
3+Валентность Cr
Атомы хрома в соединениях проявляют валентность VI, V, IV, III, II, I.
Валентность хрома характеризует способность атома Cr к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Cr 3+
Квантовые числа определяются последним электроном в конфигурации, для иона Cr эти числа имеют значение N = 3, L = 2, Ml = 0, Ms = ½
Соединения Cr(+2)
Степени окисления +2 соответствует основный оксид CrO (чёрный). Соли Cr2+ (растворы голубого цвета) получаются при восстановлении солей Cr3+ или дихроматов цинком в кислой среде («водородом в момент выделения»):
[H]
2Cr3+ → Zn,HCl 2Cr2+
Все эти соли Cr2+ — сильные восстановители вплоть до того, что при стоянии вытесняют водород из воды. Кислородом воздуха, особенно в кислой среде, Cr2+ окисляется, в результате чего голубой раствор быстро зеленеет.
Коричневый или жёлтый гидроксид Cr(OH)2 осаждается при добавлении щелочей к растворам солей хрома(II).
Синтезированы дигалогениды хрома CrF2, CrCl2, CrBr2 и CrI2
Соединения Cr(+3)
Степени окисления +3 соответствует амфотерный оксид Cr2O3 и гидроксид Cr(OH)3 (оба — зелёного цвета). Это — наиболее устойчивая степень окисления хрома. Соединения хрома в этой степени окисления имеют цвет от грязно-лилового (в водных растворах ион Cr3+ существует в виде аквакомплексов [Cr(H2O)6]3+) до зелёного (в координационной сфере присутствуют анионы).
Cr3+ склонен к образованию двойных сульфатов вида MICr(SO4)2·12H2O (квасцов)
Гидроксид хрома (III) получают, действуя аммиаком на растворы солей хрома (III):
Cr3+ + 3NH3 + 3H2O → Cr(OH)3↓ + 3NH4+
Можно использовать растворы щелочей, но в их избытке образуется растворимый гидроксокомплекс:
Cr3+ + 3OH− → Cr(OH)3↓Cr(OH)3 + 3OH− → [Cr(OH)6]3−
Сплавляя Cr2O3 со щелочами, получают хромиты:
Cr2O3 + 2NaOH → 2NaCrO2 + H2O
Непрокаленный оксид хрома(III) растворяется в щелочных растворах и в кислотах:
Cr2O3 + 6HCl → 2CrCl3 + 3H2O
При окислении соединений хрома(III) в щелочной среде образуются соединения хрома(VI):
2Na3[Cr(OH)6] + 3H2O2 → 2Na2CrO4 + 2NaOH + 8H2O
То же самое происходит при сплавлении оксида хрома (III) со щелочью и окислителями, или со щелочью на воздухе (расплав при этом приобретает жёлтую окраску):
2Cr2O3 + 8NaOH + 3O2 → 4Na2CrO4 + 4H2O
Соединения хрома (+4)
При осторожном разложении оксида хрома(VI) CrO3 в гидротермальных условиях получают оксид хрома(IV) CrO2, который является ферромагнетиком и обладает металлической проводимостью.
Среди тетрагалогенидов хрома устойчив CrF4, тетрахлорид хрома CrCl4 существует только в парах.
Соли и комплексы
Степень окисления +3 для хрома — самая термодинамически устойчивая и характерная. Стоит отметить, что электронная конфигурация хрома(III) с точки зрения теории кристаллического поля — t2g3eg0, что даёт максимальную энергию стабилизации кристаллическим полем; также катион Cr3+ имеет маленький размер и высокий заряд, что обеспечивает большую силу притяжения Cr3+-лиганд, и из-за всех этих факторов Cr3+ очень склонен к образованию комплексных частиц.
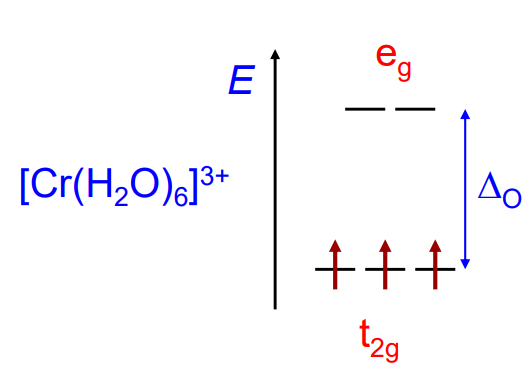
Конфигурация Cr3+ в октаэдрическом поле
Растворимые соли хрома(III) в растворе имеют окраску от фиолетовой до зелёной, зависящей от структуры и состава комплексного катиона. Если в растворе в основном присутствует октаэдрический ион гексааквахрома(III), то раствор и кристаллы имеют фиолетовый цвет. Это наблюдается, например, в хромокалиевых квасцах:
$$ce{[K(H_2O)_6][Cr(H_2O)_6](SO_4)_2}$$

Кристаллы хромокалиевых квасцов на стеклянном фильтре Шотта
Также такая комплексная частица присутствует в гидратах нитрата и сульфата хрома Cr(NO3)3 * 9H2O, Cr2(SO4)3 * 18H2O и других.
Однако, часто анионы соли могут перемещаться внутрь координационной сферы катиона, из-за чего может меняться видимый цвет соединения.
При сгорании хрома в атмосфере хлора образуется безводный хлорид хрома(III) CrCl3ярко-малинового цвета, который трудно растворить в воде из-за довольно прочной кристаллической структуры. Однако в виде гидрата трихлорид хрома имеет зелёный цвет и хорошо растворим в воде, в которой он может испытывать несколько переходов цвета. Зелёный цвет хлорида хрома вызван присутствием ионов [Cr(H2O)5Cl]2+ светло-зелёного и [Cr(H2O)4Cl2]+ тёмно-зелёного цветов, а при дальнейшем замещении аква-лигандов на хлорид-лиганды образуется катион [Cr(H2O)3Cl3]0 красного цвета. Аналогичные процессы происходят и с другими анионами, например, сульфатом, ацетатом и т. д.
Ещё одним примером комплексного соединения хрома(III) является трис(ацетилацетонат)хрома(III), структура которого представляет собой правильный тетраэдр, а по внешнему виду — это порошок фиолетового цвета:

Внешний вид Cr(acac)3
Структура Cr(acac)3
Ацетилацетонат хрома(III)
Подобную структуру также имеет анион зелёного триоксалатохромата(III) калия, который можно получить восстановлением дихромата калия щавелевой кислотой в присутствии оксалата калия:
$$ce{K_2Cr_2O_7 + 2K_2C_2O_4 + 7H_2C_2O_4 ->2K_3[Cr(C_2O_4)_3] + 7H_2O + 6CO_2(^)}$$
Соединения хрома (+6)
Степени окисления +6 соответствует кислотный оксид хрома (VI) CrO3 и целый ряд кислот, между которыми существует равновесие. Простейшие из них — хромовая H2CrO4 и двухромовая H2Cr2O7. Они образуют два ряда солей: желтые хроматы и оранжевые дихроматы соответственно.
Оксид хрома (VI) CrO3 образуется при взаимодействии концентрированной серной кислоты с растворами дихроматов. Типичный кислотный оксид, при взаимодействии с водой он образует сильные неустойчивые хромовые кислоты: хромовую H2CrO4, дихромовую H2Cr2O7 и другие изополикислоты с общей формулой H2CrnO3n+1. Увеличение степени полимеризации происходит с уменьшением рН, то есть увеличением кислотности:
2CrO42− + 2H+ → Cr2O72− + H2O
Но если к оранжевому раствору K2Cr2O7 прилить раствор щёлочи, как окраска вновь переходит в жёлтую, так как снова образуется хромат K2CrO4:
Cr2O72− + 2OH− → 2CrO42− + H2O
До высокой степени полимеризации, как это происходит у вольфрама и молибдена, не доходит, так как полихромовая кислота распадается на оксид хрома(VI) и воду:
H2CrnO3n+1 → H2O + nCrO3
Растворимость хроматов примерно соответствует растворимости сульфатов. В частности, жёлтый хромат бария BaCrO4 выпадает при добавлении солей бария как к растворам хроматов, так и к растворам дихроматов:
Ba2+ + CrO42− → BaCrO4↓2Ba2+ + Cr2O72− + H2O → 2BaCrO4↓ + 2H+
Образование кроваво-красного малорастворимого хромата серебра используют для обнаружения серебра в сплавах при помощи пробирной кислоты.
Известны пентафторид хрома CrF5 и малоустойчивый гексафторид хрома CrF6. Также получены летучие оксигалогениды хрома CrO2F2 и CrO2Cl2 (хромилхлорид).
Соединения хрома(VI) — сильные окислители, например:
K2Cr2O7 + 14HCl → 2CrCl3 + 2KCl + 3Cl2↑ + 7H2O
Добавление к дихроматам перекиси водорода, серной кислоты и органического растворителя (эфира) приводит к образованию синего монопероксида хрома(VI) CrO5 (CrO(O2)2), который экстрагируется в органический слой; данная реакция используется как аналитическая.
Оксид, кислоты и соли
Высшая степень окисления для хрома — +6, в которой ему присущи кислотные и окислительные свойства. Все соединения хрома(VI) являются очень токсиными и канцерогенными.
Существует оксид хрома(VI), CrO3 — соединение фиолетово-красного цвета, состоящее из бесконечных цепей октаэдров [CrO6]. Его также называют хромовый ангидрид, так как при растворении в воде он образует различные хромовые кислоты.

Чешуйки CrO3
При добавлении воды могут образоваться четыре кислоты, отличающихся количеством соединённых (конденсированных) групп [CrO3] — хромовая, дихромовая, трихромовая и тетрахромовая кислоты:
$$ce{CrO_3 + H_2O -> H_2CrO_4}$$
$$ce{2CrO_3 + H_2O -> H_2Cr_2O_7}$$
$$ce{3CrO_3 + H_2O ->H_2Cr_3O_{10}}$$
$$ce{4CrO_3 + H_2O -> H_2Cr_4O_{13}}$$
Все вещества представляют собой сильные кислоты, образующие устойчивые соли с многими катионами: хромат, дихромат, трихромат и тетрахромат соответственно.
Хроматы представляют собой соли жёлтого цвета, при растворении в воде окрашивающие раствор (справа на рисунке):

K2Cr2O7 (слева) и K2CrO4 (справа)
При подкислении раствора хромата два хромат-аниона конденсируются и образуется оранжевый раствор дихромата (слева на рисунке выше).
$$ce{CrO_4^{2-} + H^+ -> HCrO_4^{-}}$$
$$ce{2HCrO_4^{-} -> Cr_2O_7^{2-} + H_2O}$$
Хроматы многих тяжёлых металлов — малорастворимые в воде вещества, так, например, хромат свинца (основная часть минерала крокоита) легко может быть осаждён из раствора соли свинца хромат- или дихромат-ионами:
$$ce{Pb^2+ + CrO4^2- -> PbCrO4 v}$$
$$ce{2Pb^2+ + Cr2O7^2- + H2O -> 2PbCrO4 v + 2H+}$$

Осаждение жёлтого хромата свинца
В более кислых растворах присутствуют три- и тетрахромат-анионы, однако дальше процесс конденсации не идёт и из раствора выпадает красный триоксид хрома, представляющий из себя бесконечные цепи из хроматов:
$$ce{3Cr_2O_7^{2-} + 2H^+ -> 2Cr_3O_{10}^{2-} + H_2O}$$
$$ce{4Cr_3O_{10}^{2-} + 2H^+ -> 3Cr_4O_{13}^{2-} + H_2O}$$
$$ce{Cr_4O_{13}^{2-} + 2H^+ -> 4CrO_3(v) + H_2O}$$
Также могут быть получены и выделены соли с замещёнными хромат-анионами, например, хлорохромат калия:
$$ce{K_2Cr_2O_7 + 2HCl_{(24%)} -> 2KCrO_3Cl + H_2O}$$
Пероксиды
При добавлении к дихроматам пероксида водорода в кислой среде степень окисления хрома не меняется и образуется васильково-синее соединение, отвечающее составу K[CrO(O2)2OH] — соль надхромовой кислоты:
$$ce{K_2Cr_2O_7 + 4H_2O_2 -> 2K[CrO(O_2)_2OH] + 3H_2O}$$

Пентагонально-пирамидальная структура пероксида
Комплекс пероксида хрома с диэтиловым эфиром
Однако при добавлении эфира, пиридина или другого органического растворителя, в органический слой экстрагируется стабилизированная этим лигандом форма пероксида хрома. Для этого требуется, чтобы взятый органический растворитель мог выступать в качестве лиганда:

Комплекс пероксида хрома с пиридином
Основные характеристики
Характеристика химического элемента хрома обусловлена тем, что он является переходным металлом четвертого периода таблицы Менделеева и расположен между ванадием и марганцем. Входит в VI группу. Плавится при температуре 1907 °С. В присутствии кислорода хром быстро образует тонкий слой оксида, который защищает металл от дальнейшего взаимодействия с кислородом.
Как переходный элемент, он реагирует с веществами в различных соотношениях. Таким образом он образует соединения, в которых имеет различные степени окисления. Хром – химический элемент с основными состояниями +2, +3 и +6, из которых +3 является наиболее устойчивым. Кроме того, в редких случаях наблюдаются состояния +1, +4 и +5. Соединения хрома в степени окисления +6 представляют собой сильные окислители.
Какого цвета хром? Химический элемент придает анодированному алюминию рубиновый оттенок. Сг2O3, используемый для полировки металла, также применяется в качестве пигмента под названием «хромовая зелень». Его соли окрашивают стекло в изумрудно-зеленый цвет. Хром – химический элемент, присутствие которого делает рубин красным. Поэтому он используется в производстве синтетических рубинов.

Применение
Хром – химический элемент, свойства которого обеспечили ему множество различных вариантов применения, некоторые из которых приведены ниже.
Металлам он придает устойчивость к коррозии и глянцевую поверхность. Поэтому хром входит в состав таких сплавов, как нержавеющая сталь, используемых, например, в столовых приборах. Он также применяется для нанесения хромированного покрытия.
Хром является катализатором различных реакций. Из него делают формы для обжига кирпича. Его солями дубят кожу. Бихромат калия применяют для окисления органических соединений, таких как спирты и альдегиды, а также для очистки лабораторной посуды. Он служит фиксирующим агентом для окрашивания ткани, а также используется в фотографии и фотопечати.
CrO3 применяется для изготовления магнитных лент (например, для аудиозаписи), которые обладают лучшими характеристиками, чем пленки с оксидом железа.
Металлургия
Отрасль, забирающая три четверти объемов металла. Хромом легируют стали для улучшения кондиций.
Получают продукт:
- нержавеющий;
- износостойкий;
- жаропрочный.
Такие достоинства сталей обусловили их применение как материала стволов артиллерии, корпусов субмарин, сейфов, металлорежущего, медицинского, химического инструментария. Из них выполнены двигатели космических кораблей, начинка плазмотронов.
Даже незначительное количество хрома в составе кратно улучшает механические свойства материала.
Самые известные хромсодержащие сплавы – с никелем (нихром) и железом (фехраль). Это прецизионные материалы с повышенным электрическим сопротивлением. Используются для работы при экстремальных температурах.

Другие отрасли промышленности
Продукция из металла и сплавов с ним выпускается для разных сегментов рынка:
- Кирпичи – корпус металлургических печей.
- Нагревательные элементы (сплав с никелем).
- Хирургический инструментарий (сплав с никелем, молибденом, кобальтом).
- Соединения хрома пригождаются при производстве спичек, обуви, одежды (знаменитая блестяще-прочная хромовая кожа), окраске текстиля, обработке мебельной древесины.
- Зеленую хромовую краску наносят на керамику перед покрытием глазурью и обжигом.
Краски из перетертых хромовых руд применяли еще иконописцы Древней Руси.
- Трехвалентный оксид металла – исходник при выращивании синтетических рубинов для лазеров.
- Зеленые огни салюта – заслуга хрома.
Хром закупают фармацевтические гиганты, производители биодобавок, препаратов для похудения.
Декор
Хромированное покрытие корпуса часов либо деталей авто – не только маркер статусности. Такая обработка защищает от износа, коррозии, механических повреждений.
Толщина покрытия металлом зависит от назначения изделия: от 2 мкм (декоративный ассортимент) до 0,1 мм (детали байков, велосипедов, авто).
Процесс покрытия хромом называется хромированием. Он технологически прост и недорог.
Марки хрома и сплавов
Для нужд промышленности используется как чистый металл с большим содержанием Cr, так и его сплав с железом — феррохром. Ниже перечислены марки чистого Cr.
- Х99Н1, Х99Н2, Х99Н4, Х99Н5 — хром с содержанием Cr не менее 99% и примесью N; поставляется в виде кусков и частиц.
- ЭРХ-0, ЭРХ-1, ЭРХ-2 — хром высокой чистоты с минимальным содержанием Cr 99,99%, 99,95% и 99,95% соответственно; производится в форме чешуек или порошка.
- ПХ-1, ПХ-2 — металлический хром в виде порошка с 99,12% и 98,8% Cr соответственно.
Достоинства / недостатки
Достоинства:
- имеет достаточно высокую температуру плавления;
- обладает хорошей твердостью — один из самых твердых среди чистых металлов (уступает вольфраму, иридию и некоторым другим);
- стоек к коррозии.
Недостатки:
- характеристики сильно ухудшаются при наличии примесей;
- из-за высокой твердости хрома для получения пластичного металла необходима его дополнительная обработка.
Роль в биологии
Трехвалентный хром – химический элемент, необходимый для метаболизма сахара в организме человека. Напротив, шестивалентный Cr очень токсичен.
Меры предосторожности
Металлический хром и соединения Cr (III), как правило, не считаются опасными для здоровья, но вещества, содержащие Cr (VI), могут быть токсичными, если их принимать внутрь или вдыхать. Большинство таких веществ оказывают раздражающее действие на глаза, кожу и слизистые оболочки. При постоянном воздействии соединения хрома (VI) могут вызвать повреждение глаз, если их не лечить должным образом. Кроме того, это признанный канцероген. Смертельная доза данного химического элемента – около половины чайной ложки. Согласно рекомендациям Всемирной организации здравоохранения, предельно допустимая концентрация Cr (VI) в питьевой воде составляет 0,05 мг на литр.
Так как соединения хрома используются в красителях и для дубления кожи, они часто встречаются в почве и грунтовых водах заброшенных промышленных объектов, требующих экологической очистки и восстановления. Грунтовка, содержащая Cr (VI), до сих пор широко применяется в аэрокосмической промышленности и автомобилестроении.
- https://chem.ru/hrom.html
- https://FB.ru/article/275778/hrom-himicheskiy-element-opisanie-svoystva-formula-i-harakteristika
- http://himege.ru/xrom-svojstva/
- https://k-tree.ru/tools/chemistry/periodic.php?element=Cr&oxidation=3
- https://chemtoday.ru/data/chemistry/chromium/
- https://separett.su/stal-i-obrabotka/kak-vyglyadit-hrom.html
- https://www.metotech.ru/hrom-opisanie.htm





