Содержание
- 1 Литий – металл или неметалл?
- 2 Структура и характеристики
- 3 История открытия и изучения
- 4 В природе
- 5 Месторождения и добыча
- 6 Где в России добывают литий и производят литиевую продукцию?
- 7 Промышленное получение
- 8 Свойства
- 9 Энергия ионизации
- 10 Биологическое значение
- 11 Сферы применения
- 12 Соединения с литием
Литий – металл или неметалл?
Его название связано с греческим словом «камень» и впервые звучало как «литион». Все из-за того, что обнаружен он был в камнях или же минералах. До XIX века не было известно, металл литий или неметалл. О существовании такого элемента никто и не догадывался, пока швед Иоганн Авфердсон в 1817 году не обнаружил неизвестную щелочь в минералах сподумене и петалите.
Из-за активности вещества ученому не удалось получить из щёлочи элемент. Зато годом позже это сделал англичанин Хэмфпри Дэви посредством электролиза. После этого его можно было изучать, и научный мир смог узнать, что такое литий. Оказалось, что это легкий и мягкий металл с довольно интересными свойствами.

Уже через четверть века его научились получать промышленным путём и сразу нашли ему применение. Литий использовали в медицине, назначая его от головной боли, подагры и ревматизма. Хотя реальная его польза при этих недугах доказана не была. В XX веке на основе карбоната лития появился напиток с лимоном и лаймом. Сейчас он известен как 7Up, но соединения металла в него уже не входят.
Краткое описание
Литий — щелочной металл, который имеет выраженные пластичные свойства, серебристый цвет, характерный металлический блеск. Его легко обрабатывать, он имеет низкую температуру плавления — 180°C. Если сравнивать его с другими щелочными металлами, он обладает самой низкой плотностью. Поскольку она ниже чем у воды, материал всплывает на поверхность.
Из четырех процентов
История открытия лития началась с …математики. Химик Арфведсон анализировал минерал с рудника Уто. Ученый определил, что это обычный алюмосиликат, и содержание в нем алюминия, кремния и кислорода составляет 96%. Настырный химик задумался — что с оставшимися 4%. Отделив основные составляющие и растворив остаток, он получил раствор со щелочными свойствами. Логично было предположить, что открыт новый элемент.

Описанием минерала, из которого извлекли новый элемент, служат слова: «обычный булыжник». Потому и назвали новый металл литием (litos по латыни камень).
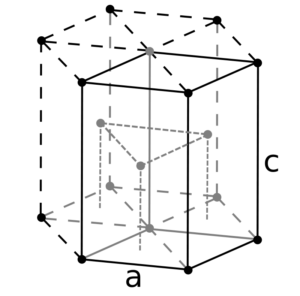
Структура и характеристики
Структура кристаллической решетки металлического лития — кубическая, объемноцентрированная. Ее параметры — 3,490 Å. Данные характеристики соблюдаются только при комнатной температуре.
Атом лития имеет две оболочки — внешнюю и внутреннюю. На внешней расположены электроны. Они участвуют в образовании химических связей.
История открытия и изучения
Первый образец металлического лития был получен благодаря работе Гемфри Дэви. С помощью электрического тока он разложил расплав гидроксида этого щелочного металла. Через некоторое время Леопольд Гмелин проэкспериментировал с литиевосодержащими солями. Он смог выявить, что они окрашивают пламя в темный цвет.
Основная заслуга в открытии нового химического элемента и росте его популярности принадлежит Иоганну Августу. В 1817 году он нашел новое вещество в составе петалита, алюмосиликата. Через некоторое время литий нашли и в других минеральных образованиях. Такое название он получил из-за того, что впервые был найден в камнях. Название камня по гречески — «литос».
Распространенность лития
Вселенная состоит из лития на 6×10-7% Солнце состоит из лития на 6×10-9% Мировой океан состоит из лития на 0.000018% Человеческое тело состоит из лития на 3×10-6%
В природе
На нашей планете литий встречается только в соединениях. Он содержится в морской воде в количестве примерно 0,17 мг/л и в сильносолёных озёрах. Он также содержится в верхний слоях земной коры в количестве 21 г/т.
Литий в основном содержится в лепидолитах, сподуменах, петалитах, литиофилитах, амблигонитах и циннвальдитах. Встречается вместе с редкими элементами в пегматитах и онгонитах. Он может образовывать самостоятельные минералы, а может замещать в них калий.

Металл присутствует и в космосе, главным образом в звездах-гигантах. Огромное количество лития находится в объекте Торна-Житкова, который состоит из красного гиганта с нейтронной звездой внутри.
Месторождения и добыча
Литий содержится в разных минералах. Самые богатые по содержанию этого щелочного металла камни — слюда лепидолит, пироксен сподумен. Литий можно найти в разных породообразующих минералах. В них он замещает кальций.
Основные месторождения этого металла находятся в Боливии, Чили, Аргентине, США, Китае, Конго, Сербии, Бразилии, Австралии, России.
Где в России добывают литий и производят литиевую продукцию?
Собственная добыча лития в России была полностью утрачена после распада СССР. Первый литиевый рудник был введен в эксплуатацию еще в 1941 году в Восточном Забайкалье, на Завитинском месторождении сподумена. Предприятие проработало 56 лет и было законсервировано в 1997 году в связи с изменением экономической ситуации. С конца 1990-х годов из-за закрытия единственного рудника в Восточном Забайкалье литиевую продукцию импортировали в основном из Чили, Боливии, Аргентины, США и Китая.
В 2017 году в России была запущена экспериментальная установка, позволяющая добывать литий из бедных руд с небольшими затратами. Внедряемая технология поможет обеспечить потребность страны в литии полностью за счет собственных запасов и избавиться от импортного сырья.
Запасы лития в России, по оценке экспертов Аналитического кредитного рейтингового агентства (АКРА), составляют около 900 тыс. тонн. Более 50% запасов сосредоточено в редкометалльных месторождениях Мурманской области. Производство литиевой продукции ведется на Сибирском химическом комбинате (Северск), а также на Химико-металлургическом заводе (Красноярск), Новосибирском заводе химических концентратов, также им занимается «ТД Халмек» (Москва).
Промышленное получение
Для получения лития промышленными способами сначала происходит подготовка расходного сырья — минералов или солевых растворов, которые добываются из соляных озер. Независимо от способа добычи расходного сырья, на выходе получается Li2CO3, который будет проходить промышленную обработку.
Способы получения расходного сырья:
- электролиз;
- восстановление;
- рафинирование.
Выбор промышленного способа получения щелочного металла зависит от наличия оборудования, требуемого результата, вида расходного сырья.
Свойства
Свойства элемента известны ученым давно. По сравнению с другими щелочными металлами он имеют ряд уникальных особенностей, по которым определяются основные сферы применения этого вещества.
Основные параметры лития по таблице Менделеева
Атомный номер Z 3 Атомная масса 6.941 Группа 1 Период 2 Принадлежность к группе щелочные металлы
Химические
Свойства:
- молярная масса — 6,941;
- валентность — 1;
- электроотрицательность — 1;
- атомный номер — 3;
- ковалентный радиус — 1,23 А;
- теплоемкость — 3,307 кДж/(кг·°С).
Литий проявляет стабильность находясь на воздухе. Из группы щелочных металлов он наименее активный. Про взаимодействии с сухим воздухом и кислородом практические не реагирует (при условии соблюдения комнатной температуры).
Взаимодействие лития с водой проходит относительно спокойно. При контакте с водой он начинает образовывать щелочь, выделять кислород. Металл плавает на поверхности жидкости, быстро растворяясь и издавая характерное шипение.
При влажном воздухе металл вступает в реакции с газами, которые содержатся в нем (особенно с азотом). Оксидная пленка покрывает поверхности лития при нагревании до 100–300°C. Пленка защищает металл от окислительных процессов.
При реакции с серой образуется сульфид (при условии нагревания до 130°C). С кремнием вступает в реакцию при нагревании до 700°C. Растворяется в жидком аммиаке, образуя раствор синего цвета.
Литий нельзя хранить в керосиновой жидкости. Из-за малой плотности материал всплывет на поверхность. Для хранения подойдет минеральное масло, газолин, парафин. Емкость лучше выбирать из жести. Она должна герметично закрываться.
Электронная схема лития
Li: 1s2 2s1 → Li-: 1s22s2
Одинаковую электронную конфигурацию имеют ион лития -1 и Be, +1B, +2C, +3N
Порядок заполнения оболочек атома лития (Li-) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на ‘d’ — до 10 и на ‘f’ до 14
Литий имеет 3 электрона, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
Степень окисления лития
Атомы лития в соединениях имеют степени окисления 1, -1.
Степень окисления — это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Степень окисления иона Li- = -1
Ионы лития
1+Li
Li 1-0Li
Валентность Li
Атомы лития в соединениях проявляют валентность I.
Валентность лития характеризует способность атома Li к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Li 1-
Квантовые числа определяются последним электроном в конфигурации,
для иона Li эти числа имеют значение N = 2, L = 0, Ml = 0, Ms = ½
Качественные реакции
Качественная реакция на щелочные металлы — окрашивание пламени солями щелочных металлов.

Цвет пламени:
Li — карминно-красный
Na — жѐлтый
K — фиолетовый
Rb — буро-красный
Cs — фиолетово-красный
Физические свойства лития:
| 400 | Физические свойства | |
| 401 | Плотность | 0,534 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), 0,512 г/см3 (при температуре плавления 180,50 °C и иных стандартных условиях, состояние вещества – жидкость), 0,507 г/см3 (при 200 °C и иных стандартных условиях, состояние вещества – жидкость), 0,49 г/см3 (при 400 °C и иных стандартных условиях, состояние вещества – жидкость), 0,474 г/см3 (при 600 °C и иных стандартных условиях, состояние вещества – жидкость), 0,457 г/см3 (при 800 °C и иных стандартных условиях, состояние вещества – жидкость), 0,441 г/см3 (при 1000 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления* | 180,50 °C (453,65 K, 356,90 °F) |
| 403 | Температура кипения* | 1330 °C (1603 K, 2426 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 3,00 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 136 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 3,4122 Дж/г·K (при 25°C) |
| 410 | Молярная теплоёмкость | 24,86 Дж/(K·моль) |
| 411 | Молярный объём | 13,1 см³/моль |
| 412 | Теплопроводность | 84,8 Вт/(м·К) (при стандартных условиях), 84,8 Вт/(м·К) (при 300 K) |
| 413 | Коэффициент теплового расширения | 46 мкм/(М·К) |
| 414 | Коэффициент температуропроводности | |
| 415 | Критическая температура | |
| 416 | Критическое давление | |
| 417 | Критическая плотность | |
| 418 | Тройная точка | |
| 419 | Давление паров (мм.рт.ст.) | |
| 420 | Давление паров (Па) | |
| 421 | Стандартная энтальпия образования ΔH | |
| 422 | Стандартная энергия Гиббса образования ΔG | |
| 423 | Стандартная энтропия вещества S | |
| 424 | Стандартная мольная теплоемкость Cp | |
| 425 | Энтальпия диссоциации ΔHдисс | |
| 426 | Диэлектрическая проницаемость | |
| 427 | Магнитный тип | |
| 428 | Точка Кюри | |
| 429 | Объемная магнитная восприимчивость | |
| 430 | Удельная магнитная восприимчивость | |
| 431 | Молярная магнитная восприимчивость | |
| 432 | Электрический тип | |
| 433 | Электропроводность в твердой фазе | |
| 434 | Удельное электрическое сопротивление | |
| 435 | Сверхпроводимость при температуре | |
| 436 | Критическое магнитное поле разрушения сверхпроводимости | |
| 437 | Запрещенная зона | |
| 438 | Концентрация носителей заряда | |
| 439 | Твёрдость по Моосу | |
| 440 | Твёрдость по Бринеллю | |
| 441 | Твёрдость по Виккерсу | |
| 442 | Скорость звука | |
| 443 | Поверхностное натяжение | |
| 444 | Динамическая вязкость газов и жидкостей | |
| 445 | Взрывоопасные концентрации смеси газа с воздухом, % объёмных | |
| 446 | Взрывоопасные концентрации смеси газа с кислородом, % объёмных | |
| 446 | Предел прочности на растяжение | |
| 447 | Предел текучести | |
| 448 | Предел удлинения | |
| 449 | Модуль Юнга | |
| 450 | Модуль сдвига | |
| 451 | Объемный модуль упругости | |
| 452 | Коэффициент Пуассона | |
| 453 | Коэффициент преломления |
Кристаллическая решётка лития:
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая объёмно-центрированная
|
| 513 | Параметры решётки | 3,510 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 400 K |
| 516 | Название пространственной группы симметрии | Im_ 3m |
| 517 | Номер пространственной группы симметрии | 229 |
| 521 | Кристаллическая решётка #2 | |
| 522 | Структура решётки | Гексагональная плотноупакованная
|
| 523 | Параметры решётки | a = 3,111 Å, c = 5,093 Å |
| 524 | Отношение c/a | 1,637 |
| 525 | Температура Дебая | |
| 526 | Название пространственной группы симметрии | P63/mmc |
| 527 | Номер пространственной группы симметрии | 194 |
Электрические свойства лития
Тип электрической проводимости проводник
Магнитные свойства лития
Тип магнитной проницаемости парамагнетик
Термодинамические свойства лития
Агрегатное состояние при нормальных условиях твердое тело Точка плавления по Кельвину 453.69 (Кельвин) Точка плавления по Цельсию 180.54 (°C) Точка кипения по Кельвину 1615.15 (Кельвин) Точка кипения по Цельсию 1342 (°C)
Оптические свойства лития
Цвет Серебряный Спектр излучения лития

Спектр поглощения лития

Механические свойства лития
Плотность твердых веществ 0.535 · 103 (Килограмм / Метр 3) Скорость звука 6000 (Метр / Секунда)
Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать. Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo. Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии ионизации для каждого последующего электрона.
Энергия ионизации Li:
Eo = 520 кДж/моль
Биологическое значение
Элемент был обнаружен в числе постоянных компонентов в живых организмах. У растений он повышает стойкость к различным заболеваниям. Вещество усиливает фотохимическую активность хлоропластов в листве томатов и синтез никотина в табаке.
В человеческом организме литий образуется преимущественно в почках, но также находится в щитовидной железе, печени, сердце, лёгких и кишечнике. Этот элемент участвует в важных процессах жизнедеятельности организма человека:
- нормализует обмены жиров и углеводов;
- укрепляет иммунную систему;
- не даёт развиться аллергическим реакциям;
- снижает нервную возбудимость.
В большом количестве вещество снижает уровень серотонина в мозге. При высоком содержании натрия в организме препараты с литием назначают с осторожностью, поскольку лекарства могут быть опасны для здоровья и ухудшить состояние почек.
Сферы применения
Используется при изготовлении:
- Термоэлектропреобразователей.
- Высокоэффективных лазеров.
- Пиротехники. С его помощью окрашивают пламя фейерверков в красный цвет.
- Припоев.
- Металлогалогеновых ламп, щелочных аккумуляторов.
- Смазочных материалов.
- Стекла, покрытий для фарфоровых изделий.
Основные сферы применения:
- ядерная энергетика;
- металлургия;
- медицина.
Перхлорат щелочного металла используется в качестве окислителя.
Плюсы и минусы литиевых батарей
Эти аккумуляторы и батареи просты в эксплуатации, они постоянно готовы к эксплуатации.

Литиевые источники тока
| Достоинства | Недостатки |
| Хороший ресурс эксплуатации (до 10 лет) | Взрывоопасны при нарушении герметичности корпуса |
| Запас циклов зарядки-разрядки более 1000 | Срок службы зависит от времени работы (не от количества циклов зарядка-разрядка) |
| Нет «эффекта памяти» (батареи можно регулярно подзаряжать) | Работает в ограниченном температурном диапазоне (от -20 до +50оС) |
| Легкий вес | Высокая цена |
К сведению: Нобелевская премия по химии присуждена за литийионные батареи.
Соединения с литием
Соединения на основе щелочного металла
- оксид лития — Li2O;
- пероксид — Li2O2;
- гидроксид — LiOH;
- карбонат — Li2CO3;
- нитрат — LiNO3;
- фторид — LiF;
- хлорид — LiCl;
- гидрид — LiH;
- стеарат — Li(C17H35COO).
Литий — щелочной металл с уникальными свойствами. Он применяется в разных сферах деятельности. Добывается из разных минералов и проходит дополнительную обработку.
- https://FB.ru/article/359774/litiy-metall-ili-nemetall-svoystva-i-primenenie-litiya
- https://metalloy.ru/metally/litiy
- https://TheMineral.ru/metally/litij
- https://www.fxyz.ru/%D1%84%D0%BE%D1%80%D0%BC%D1%83%D0%BB%D1%8B_%D0%BF%D0%BE_%D1%85%D0%B8%D0%BC%D0%B8%D0%B8/%D0%BF%D0%B5%D1%80%D0%B8%D0%BE%D0%B4%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D1%81%D0%B8%D1%81%D1%82%D0%B5%D0%BC%D0%B0_%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82%D0%BE%D0%B2_%D1%82%D0%B0%D0%B1%D0%BB%D0%B8%D1%86%D0%B0_%D0%BC%D0%B5%D0%BD%D0%B4%D0%B5%D0%BB%D0%B5%D0%B5%D0%B2%D0%B0/%D0%BB%D0%B8%D1%82%D0%B8%D0%B9/
- https://aif.ru/money/business/gde_primenyaetsya_litiy
- https://k-tree.ru/tools/chemistry/periodic.php?element=Li&oxidation=-1
- https://chemege.ru/alkalimetals/
- https://ChemicalStudy.ru/litiy-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
- https://k-tree.ru/tools/chemistry/periodic.php?element=Li
- https://nauka.club/khimiya/litii.html